微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某有机物A与氢气的相对密度是38,取有机物A 7.6g完全燃烧后,生成0.2molCO2和0.2molH2O。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应。
下列有关A的说法中不正确的是(?)
A.A的分子式为C2H4O3
B.A的结构简式为HO—CH2—COOH
C.A分子中的官能团有两种
D.1 mol A与足量的单质Na反应时放出H2的物质的量为0.5mol
参考答案:D
本题解析:有机物A与氢气的相对密度是38,则A的相对分子质量是76。所以7.6g有机物的物质的量是0.1mol,则根据原子守恒可知,A中含有的碳、氢原子个数分别是2和4.所以含有的氧原子个数是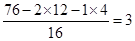 ,即分子式为C2H4O3。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应,所以分子含有羧基和羟基,因此选项D不正确,应该是1mol氢气,其余选项都是正确的,答案选D。
,即分子式为C2H4O3。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应,所以分子含有羧基和羟基,因此选项D不正确,应该是1mol氢气,其余选项都是正确的,答案选D。
点评:计算有机物的分子式是,关键是利用各种守恒法进行,特别是能否准确判断出是否氧原子。
本题难度:一般
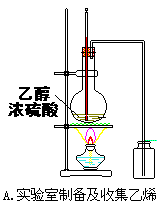
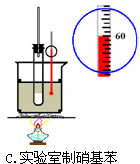
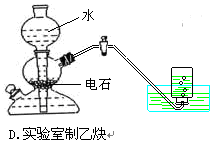
2、选择题 下列实验装置图正确的是
 ?
?
 ?
?
参考答案:C
本题解析:A.实验室收集乙烯时不能用排空气法,应用排水法,故A错误;
B.石油分馏冷凝水应下进上出,温度计应位于蒸馏烧瓶支管口处,测量的是蒸气的温度,故B错误;
C.实验室制硝基苯水浴加热控制在50到60度,故C正确;
D.反应生成的氢氧化钙容易堵住进水口,不应使用启普发生器,故D错误.
故选C。
点评:本题考查了常见气体制备原理及装置选择,根据反应物的状态及反应条件,可把实验室制备气体发生装置分为:固体、固体加热型,如加热高锰酸钾制取氧气;固体、液体加热型,如制取氯气;固体、液体不加热型,如用稀硫酸和锌粒制取氢气。
本题难度:一般
3、计算题 某烃,在标准状态下呈气态,取10cm3该烃跟70cm3氧气混合,并用电火花引燃。反应后先使水蒸气冷凝,测出混合气体的体积是65cm3,再将气体通过氢氧化钾溶液,剩余的气体的体积为45cm3。所有的气体体积都是在标准状态下测定的,试求这种烃的分子式。
参考答案:C2H2
本题解析:解答本题关键的一点是判断氧气是不是过量。
若氧气过量,生成CO2为20mL,参加反应的O2为25mL
设烃的分子式为CXHY,则x=2,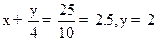 ,烃为C2H2(乙炔)
,烃为C2H2(乙炔)
若氧气不足,则生成CO2为25mL,CO为45mL
设烃的分子式为CXHY,则x= 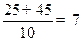 ,此时烃在标准状况下为非气态,不合题意。
,此时烃在标准状况下为非气态,不合题意。
依题意判断在反应中氧气过量。反应消耗的氧量为(70 cm3-45 cm3)=25cm3,生成CO2为20cm3
CxHy+(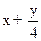 ?)O2→xCO2+
?)O2→xCO2+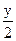 ?H2o
?H2o
1?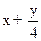 ?x
?x
10? 25? 20
解得:x=2,y=2
烃是C2H2(乙炔)。
本题难度:一般
4、计算题 某有机物A有C、H、O三种元素组成,现取18g A在足量O2中充分燃烧,将燃烧产物全部依次通过无水氯化钙和碱石灰后,固体质量的增加依次为10.8g和26.4g,
求:
(1)A的最简式是???。
(2)若常温下A是气体,则A的结构式是???。
(3)若0.1molA含4.8g氧,A在浓硫酸作用下能生成六元环状化合物,写出该反应的化学方程式???。
参考答案:(每空2分,共6分)
(1)CH2O(2)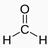
(3)2
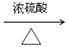
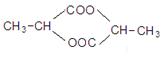 +2H2O
+2H2O
本题解析:(1). n(H2O)=10.8/18=0.6mol? n(H)=1.2mol
n(CO2)=26.4/44=0.6mol? n(C)=0.6mol
m(O)=18-0.6?2-0.6?12=9.6g
n(O)=9.6?16=0.6mol
C:H:O=1:2:1
故最简式为CH2O
(2)若常温下A是气体,则A是甲醛,A的结构简式是: HCHO
(3)0.1molA含4.8g氧则说明A分子中有3个氧原子,A的分子式为C3H6O3,A在浓硫酸作用下能生成六元环状化合物则说明A可以分子内酯化成环酯。A分子中含有羟基和羧基。能生成六元环状化合故A的结构简式为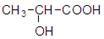 ,反应的化学方程式为:
,反应的化学方程式为:
2

 +2H2O
+2H2O
点评:此题考查有机物分子式的确定和计算。分子结构的推断。
本题难度:一般
5、选择题 5 ℃和101 kPa时,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为
A.12.5%
B.25%
C.50%
D.75%
参考答案:B
本题解析:根据反应:C2H6+3.5O22CO2+3H2O;C2H2+2.5O22CO2+H2O;C3H6+4.5O23CO2+3H2O。设混合烃中C2H6为a mL,C2H2为b mL,C3H6为c mL,则有:a+b+c=32①;2.5(a+c)+1.5b=72②,解方程①②可得b=8,故原混合烃中乙炔的体积分数为25%。
本题难度:一般