微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列制品与材料类别不对应的是
A
| B
| C
| D
|

玻璃
| 
| 
不锈钢
| 
玻璃钢
|
无机非金属材料
| 有机高分子材料
| 金属材料
| 复合材料
参考答案:B
本题解析:A、玻璃属于无机非金属材料,正确;B、氮化硅陶瓷属于无机非金属材料,错误;C、不锈钢是铁、碳等的合金,属于金属材料,正确;D、玻璃钢是玻璃纤维与合成材料塑料复合而成的一种特殊材料,属于复合材料,正确,答案选B。
本题难度:一般
2、选择题 在水玻璃中通入足量的CO2气体,充分反应后,加热蒸发,再高温灼烧,则最后所得的固体物质为( )
A.Na2SiO3
B.SiO2与Na2CO3
C.SiO2
D.SiO2与NaHCO3
参考答案:A
本题解析:
本题难度:一般
3、选择题 钛和钛合金是21世纪的重要金属材料。它们具有优良的性能,如熔点高、密度小、可塑性好、机械性能好、抗腐蚀能力强,钛合金与人体有很好的“相容性”。根据它们的主要性能,不合实际的用途是
A.用于核潜艇设备的制造
B.用于制造航天设备
C.用来作保险丝
D.可用来制造人造骨
参考答案:C
本题解析:因钛的熔点高,故不适合作保险丝。
本题难度:简单
4、填空题 (12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分
| 含量/(mg?L-1)
| 成分
| 含量/(mg?L-1)
| Cl-
| 18980
| Ca2+
| 400
| Na+
| 10560
| HCO3-
| 142
| SO42-
| 2560
| Br-
| 64
| Mg2+
| 1272
| ?
| ?
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
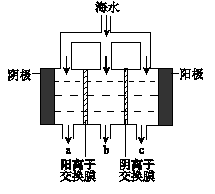
①阳极主要电极反应式是?。
②在阴极附近产生少量白色沉淀,其成分有?和CaCO3,生成CaCO3的离子方程式是?。
③淡水的出口为?(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br-→Br2转化的目的是?,吸收塔中发生反应的离
子方程式是?。用平衡移动原理解释通空气的目的是?。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是?、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为?L(忽略Cl2溶解)。
参考答案:(12分)
(1)①(1分)2Cl—-2e—=Cl2↑
②(1分)Mg(OH)2?(2分)Ca2++ OH—+HCO3—=CaCO3↓+H2O
③(1分)b
(2)①(1分)对溴元素进行富集?(2分)SO2+Br2+2H2O=4H++2Br—+SO42—
(1分)通入空气将Br2蒸气带出,使Br2(g) Br2(aq)或 Br2(aq)或
Br2+H2O HBr+HBrO平衡向左移动 HBr+HBrO平衡向左移动
②(1分)加热浓缩、冷却结晶
③(2分)182
本题解析:(1)在阳极放电的离子为阴离子,且阴离子的放电能力由强到弱的顺序为:S2->I->Br->CL->OH->含氧酸根离子>F-,所以该阳极的电极反应式为CL-放电。
在阴极放电的离子为阳离子,且阳离子的放电能力由强到的顺序为:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>AL3+>Mg2+>Na+>Ca2+>K+;所以该阴极的电极反应式为H+(水)放电,破坏了水的电离平衡,使阴极附近OH-浓度增大;
(2)在滤液中通入CL2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,进入吸收塔与SO2反应,其反应的离子方程式为:SO2+Br2+2H2O=4H++2Br—+SO42—;再通入CL2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集;
本题难度:一般
5、选择题 当向下列各组溶液中分别通入CO2后,可能产生白色沉淀的是( )
①澄清石灰水②CaCl2溶液③Ca(HCO3)2溶液④CaCl2和氨水的混合溶液.
A.①④
B.②③
C.①③
D.①②
参考答案:A
本题解析:
本题难度:简单
|