|
高中化学知识点总结《难溶电解质的溶解平衡》高频考点强化练习(2017年最新版)(六)
2017-07-27 11:07:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 14.向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag+ + 2NH3·H2O 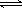 Ag(NH3+)2+ 2H2O。下列分析不正确的是 Ag(NH3+)2+ 2H2O。下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl (s) 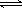 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq)
B.实验可以证明NH3结合Ag+能力比Cl-强
C.实验表明实验室可用氨水洗涤银镜反应后的试管
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
|
参考答案:C
本题解析:氯化银为常见的难溶物,存在的溶解平衡为AgCl (s) 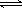 Ag+(aq)+Cl-(aq);向AgCl浊液中滴加氨水后,沉淀溶解,得到澄清溶液,继续滴加浓硝酸后又有沉淀生成,又Ag+ + 2NH3·H2O Ag+(aq)+Cl-(aq);向AgCl浊液中滴加氨水后,沉淀溶解,得到澄清溶液,继续滴加浓硝酸后又有沉淀生成,又Ag+ + 2NH3·H2O 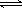 Ag(NH3+)2+ 2H2O,可知NH3结合Ag+能力比Cl-强;实验室做完银镜反应的试验后,可用稀硝酸洗涤银镜反应后的试管;AgCl浊液中加氨水,形成了银氨溶液,加入浓硝酸后,浓硝酸与氨水反应,最终得到的物质为AgCl。 Ag(NH3+)2+ 2H2O,可知NH3结合Ag+能力比Cl-强;实验室做完银镜反应的试验后,可用稀硝酸洗涤银镜反应后的试管;AgCl浊液中加氨水,形成了银氨溶液,加入浓硝酸后,浓硝酸与氨水反应,最终得到的物质为AgCl。
考点:难溶物的溶解平衡
点评:本题主要考查了难溶物的溶解平衡,关键是要掌握难溶物的溶解平衡的原理,本题稍有难度。
本题难度:一般
2、填空题 重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:
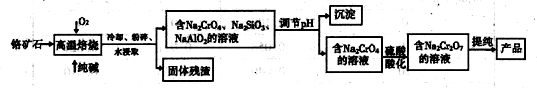
请回答下列问题:
(1)写出Cr2O3在高温焙烧时反应的化学方程式______________________
(2)写出硫酸酸化使Na-2CrO4转化为Na2Cr2O7的离子方程式 ______________。
(3)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到? Na2Cr2O7的转化,其原理如图所示。

①钠离子交换膜的一种材料是聚丙烯酸钠(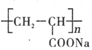 ),聚丙烯酸钠单体的结构简式是________; ),聚丙烯酸钠单体的结构简式是________;
②写出阳极的电极反应式__________
(4) Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩 余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为______________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是 _______.
(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,
参考答案:
(1)2Cr2O3 + 4Na2CO3 + 3O2  4Na2CrO4+4CO2 4Na2CrO4+4CO2
(2)2CrO42-+ 2H+= Cr2O72- + H2O
(3)①CH2=CHCOONa?②4OH- -4e- =O2↑ + 2H2O
(4)①480C1V1-80C2V2②3.2~4.3之间
本题解析:(1)Cr2O3高溫焙烧变成Na2CrO4,Cr化合价升高,有反应物可知必须有氧气充当氧化剂,生成物中有钠元素,所以纯碱参与了反应。(2) Na-2CrO4转化为Na2Cr2O7化合价没有变化,酸性条件有H+参与反应,产物中有水生成。(3)①有高聚物结构简式 写出链节,由链节改成单体CH2=CH-COONa。②阳极发生氧化反应,溶液中的阴离子OH-失电子生成氧气(4)①K2Cr2O7与两种物质反应,一是先于与水样中还原性物质反应,二是多余的K2Cr2O7与FeSO4反应。所以用K2Cr2O7的总量减去与FeSO4反应的Cr2O72-的量,即可得与还原性物质反应消耗的K2Cr2O7的量,也可折算出废水的COD。 写出链节,由链节改成单体CH2=CH-COONa。②阳极发生氧化反应,溶液中的阴离子OH-失电子生成氧气(4)①K2Cr2O7与两种物质反应,一是先于与水样中还原性物质反应,二是多余的K2Cr2O7与FeSO4反应。所以用K2Cr2O7的总量减去与FeSO4反应的Cr2O72-的量,即可得与还原性物质反应消耗的K2Cr2O7的量,也可折算出废水的COD。
本题难度:一般
3、选择题 某温下,在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )
A.[Ba2+]=[SO42-]=Ksp?
B.[Ba2+]?[SO42-]>Ksp[Ba2+]=[SO42-]
C.[Ba2+]?[SO42-]=Ksp[Ba2+]>[SO42-]
D.[Ba2+]?[SO42-]≠Ksp[Ba2+]<[SO42-]
参考答案:A、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,故A错误;
B、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,最后溶液中的溶度积常数不变,故B错误;
C、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,钡离子浓度大于硫酸根离子浓度,最后溶液中的溶度积常数不变,故C正确;
D、溶度积常数是随温度变化不随浓度改变,最后溶液中的溶度积常数不变,钡离子浓度大于硫酸根离子浓度,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
[? ]
A.只有AgBr沉淀
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
参考答案:C
本题解析:
本题难度:一般
5、简答题 下列说法中,正确的是( )
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
参考答案:A、难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀溶解平衡是动态平衡,沉淀和溶解速率相同,故A错误;
B、Ksp可用来判断相同的类型的化合物在水中溶解度的大小,但是如果化合物的形式不同,就不能进行直接判断,难溶电解质在水中的溶解能力不一定越弱,故B错误;
C、沉淀溶解平衡常存在的溶度积常数,Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关,故C正确;
D、相同温度下,AgCl在水中的溶解能力大于在NaCl溶液中的溶解能力,因为氯化钠溶液中氯离子对氯化银溶解起到抑制作用,故D错误;
故选C.
本题解析:
本题难度:一般
|