|
高中化学知识点大全《元素周期律》试题特训(2017年最新版)(二)
2017-07-27 11:08:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,名不符实的一种物质是___?_____。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时):
_____________?;______________?。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________(填序号)
A.Ag
B.Cu
C.Al
D.Fe
| (4)烧碱、纯碱溶液均可吸收CO2。向含有4.0gNaOH的溶液中通入CO2,当通入的CO2与溶液中NaOH物质的量之比为9:7时,则所得溶液中NaHCO3的质量为__? _g。(相对原子质量:H—1? C—12? O—16? Na—23)
参考答案:(13分)(1)纯碱(2分)?(2)?H++OH-===H2O (3分)? 2H++CO===CO2↑+H2O(3分)
(3)A、B (2分)?(4)? 8.4g(3分)
本题解析:略
本题难度:一般
2、选择题 12C与14C互为同位素,下列说法不正确的是( ? )
A.12C与14C具有相同的中子数
B.12C与14C具有相同的质子数
C.12C与14C具有相同的最外层电子数
D.12C与14C具有不同的质量数
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列各项比较中正确的是
A.共价键极性CCl4>SiCl4
B.沸点CH3CH2OH>CH3CH2Cl
C.元素的电负性Ca>Mg
D.晶格能KCl>NaCl
参考答案:B
本题解析:A:所涉及的Cl、C、Si元素的非金属性Cl > C > Si,所以SiCl4的极性大
B:前者为液太,后者为气态,正确;C:二者相比,前者金属性强,电负性小;
D:二者相比,Na+的半径小于K+半径,NaCl晶格能更大。
本题难度:一般
4、推断题 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3。试回答下列问题:
(1)E元素在周期表中的位置是_____________;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/mol,请写出A单质完全燃烧生成液态水时的热化学方程式:___________________;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是_____________;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于________化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为__________________;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:__________________________。
参考答案:(1)第二周期第Ⅰ主族
(2)H2(g)+1/2O2(g)==H2O(l) △H=-285.8KJ/mol
(3)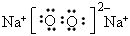
(4)①离子;②H++HSO3-==H2O+SO2↑
(5)S2- + H2O2 + 2H+ == S↓ +2H2O
本题解析:
本题难度:一般
5、选择题 下列实验的操作、现象和解释或结论都正确的是
?
| 操作
| 现象
| 解释或结论
| A
| 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4
| 溶液颜色基本不变
| Fe(NO3)2与H2SO4不反应
| B
| 向饱和Na2CO3溶液中通入足量CO2
| 溶液变浑浊
| 析出了NaHCO3晶体
| C
| 将Al2(SO4)3溶液蒸干
| 有白色固体生成
| Al3++3H2O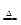 Al(OH)3↓+3H+ Al(OH)3↓+3H+
| D
| 将Na放入CuSO4溶液中
| 有红色固体析出
| 2Na+Cu2+=Cu+2Na+
|
?
参考答案:B
本题解析:A.向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4,就相当于在FeSO4中滴加HNO3。由于Fe2+有还原性,而HNO3有氧化性,二者会发生氧化还原反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。溶液会因含有Fe3+变为黄色。错误。B.向饱和Na2CO3溶液中通入足量CO2,发生反应:Na2CO3+CO2+H2O= 2NaHCO3↓。由于NaHCO3的溶解度比Na2CO3小。所以会结晶析出,而使溶液变浑浊。正确。C.将Al2(SO4)3溶液蒸干, Al2(SO4)3是强酸弱碱盐水解产生硫酸和氢氧化铝。由于硫酸没有挥发性,所以二者会重新反应得到Al2(SO4)3。当溶液蒸干后得到的白色固体就是Al2(SO4)3。错误。D.将Na放入CuSO4溶液中,由于Na非常活泼,很容易与溶液中的溶剂水发生反应:2Na+2H2O=2NaOH+H2↑,产生的NaOH再与CuSO4发生复分解反应2NaOH+ CuSO4=Cu(OH)2↓+Na2SO4.因此不会产生黄色固体。反应原理也错误。
本题难度:一般
|