微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是
[? ]
A.防止硫酸铁分解
B.抑制硫酸铁水解
C.提高硫酸铁的溶解度
D.提高溶液的pH
参考答案:B
本题解析:
本题难度:简单
2、实验题 今欲用Na2CO3固体配制500mL 0.2mol/L的Na2CO3溶液。配制过程如下图所示
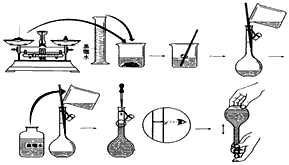
请根据题意回答
(1)配制该溶液应选用__________mL容量瓶。
(2)用托盘天平称取_________g固体Na2CO3。
(3)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用____________滴加蒸馏水至溶液凹面与刻度线____________。盖好瓶塞,摇匀。
(4)配制好的溶液____________(填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是________________
A.定容时观察液面仰视
B.定容时观察液面俯视
C.有少量Na2CO3溶液残留在烧杯中
D.容量瓶中原来有少量蒸馏水
参考答案来源:91考试网 91ExaM.org:(1)500?
(2)10.6
(3)胶头滴管;相切或相平
(4)不能
(5)AC
本题解析:
本题难度:一般
3、简答题 FeSO4?7H2O广泛用于医药和工业领域,以下是FeSO4?7H2O的实验室制备流程图.根据题意完成下列填空:

(1)操作①中碳酸钠溶液能除去油污,原因是______(用离子方程式表示).
(2)下列物质分离方法的原理与过滤相同的是______(填序号字母).
a.蒸馏?b.分液
c.渗析?d.重结晶
(3)FeSO4?7H2O是某些补血剂的主要成分,实验室中为测定某补血剂中铁元素的含量,进行了以下实验:
①配制100mL 1.00×10-2mol?L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管及______.配制过程中下列说法中,正确的是______(填序号字母).
a.KMnO4溶于水不放热,可以直接在容量瓶中溶解
b.容量瓶洗涤后不需干燥即可直接用于实验
c.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
d.如果定容时加水超过刻度线必须重新配制
②取2.0g克该补血剂配成溶液,进行预处理,使其中的铁元素全都是Fe2+,再用配制好的标准KMnO4溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.进行滴定时,标准KMnO4溶液应该盛放在______(填“酸式”或“碱式”之一)滴定管中,原因是______.
③滴定结束时,消耗浓度为1.00×10-2mol?L-1的标准KMnO4溶液26.00mL,则该补血剂中铁元素的含量为______%.
参考答案:(1)操作①中碳酸钠溶液能除去油污,溶液中碳酸根离子水溶液中水解显碱性;反应的离子方程式为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
(2)物质分离方法的原理与过滤相同的是利用滤纸把固体不溶物和溶液分离;依据透性分析判断;
a.蒸馏是分离沸点不同的混合物,故a不符合;
b.分液是利用互不相溶的液体静置分液,故b不符合;
c.渗析是利用半透膜分离溶液和胶体,和过滤原理相同,故c符合;?
d.重结晶是利用蒸发浓缩,结晶析出,故d不符合;
故答案为:c;
(3)①配制100mL 1.00×10-2mol?L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管、100mL容量瓶 玻璃棒;
a、容量瓶不能用来溶解物质,故a错误;
b、容量瓶是准确量配制溶液的量具,最后加水定容,容量瓶洗涤后不需干燥即可直接用于实验;故b正确;
c、定容后摇匀后不需要再加水,加水后溶液浓度减小,故c错误;
d、加水超出刻度,配制失败需要重新配制,故d正确;
故答案为:100mL容量瓶、玻璃棒;bd;
②KMnO4溶液具有强氧化性,不能盛放在碱式滴定管,因为高锰酸钾溶液腐蚀橡胶管,所以盛放在酸式滴定管中;
故答案为:酸式;KMnO4溶液有强氧化性能腐蚀橡胶管;
③滴定结束时,消耗浓度为1.00×10-2mol?L-1的标准KMnO4溶液26.00mL,腐蚀的反应为:设铁元素物质的量为x,
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
5? 1
x? 1.00×10-2mol?L-1×0.0260L
x=1.3×10-3mol;
铁元素质量=1.3×10-3mol×56g/mol=0.0728g
2.0g克该补血剂中铁元素含量=0.0728g2.0g×100%=3.64%
故答案为:3.64.
本题解析:
本题难度:一般
4、选择题 实验室配制1mol/L 250mL NaCl溶液,下列仪器中不需要的是( )
A.玻璃棒
B.分液漏斗
C.胶头滴管
D.250mL容量瓶
参考答案:配制1mol/L250mLNaCl溶液,配制步骤有:计算、称量、稀释、移液、洗涤移液、定容、摇匀等操作;一般用天平称量氯化钠质量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以需要的仪器为:天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
不需要的仪器是分液漏斗,
故选B.
本题解析:
本题难度:简单
5、选择题 实验室需配制一种强酸溶液500mL,c(H+)=2mol/L,下列配制方法可行的是( )
A.取100 mL 5mol/LH2SO4,加入400mL水
B.取200 mL 5mol/LHCl,加水稀释至500mL
C.取100mL 5mol/LH2SO4,加水稀释至500mL
D.取100mL 5mol/LHNO3,加水稀释至500mL
参考答案:A、100mL 5mol/L H2SO4,加入400mL水溶液的体积要小于500mL,故A错误;
B、200mL 5mol/L HCl中n(H+)=200mL×5mol/L=1mol,所以c(H+)=1mol500mL=2mol/L,故B正确;
C、100mL 5mol/L H2SO4中n(H+)=100mL×5mol/L×2=1mol,所以c(H+)=1mol500mL=2mol/L,故C正确;
D、100mL 5mol/L HNO3中n(H+)=100mL×5mol/L=0.5mol,所以c(H+)=0.5mol500mL=1mol/L,故D错误.
故选:BC.
本题解析:
本题难度:一般