微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 检查钢质设备完好的方法之一是:在被怀疑有裂纹处涂上10%的盐酸,过一段时间如观察到粗线裂纹,表明该部分确有裂纹,产生粗线裂纹的原因是
A.裂纹处尘埃起催化作用
B.裂纹处铁的表面积大,反应快
C.裂纹里面含有水分
D.原裂纹处氧化铁与盐酸反应,生成可溶性氯化物
参考答案:D
本题解析:裂纹处的铁与空气接触面积大,易被氧化,氧化后的产物与盐酸反应生成氯化铁.
本题难度:简单
2、选择题 已知HX为一元弱酸.某混合溶液中含有4mol?NaX、2mol?Na2CO3和1mol?NaHCO3.往溶液中通入3mol?CO2气体,充分反应后,气体全部被吸收,所得溶液中钠盐的量可能为
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:HX为一元弱酸,混合溶液中含NaX、Na2CO3和NaHCO3,故酸性HX>HCO3-,若酸性HX>H2CO3,则CO2与Na2CO3反应,若酸性
HX<H2CO3,CO2先与Na2CO3反应先,Na2CO3反应完毕,若CO2有剩余,再与NaX反应,故溶液中首先发生反应:Na2CO3+CO2+H2O=2NaHCO3,由方程式可知2molNa2CO3消耗2molCO2,故剩余1molCO2,由气体全部被吸收,故酸性HX<H2CO3,还发生反应NaX+CO2+H2O=HX+NaHCO3,据此计算结合进行判断.
解答:溶液中首先发生反应:Na2CO3+CO2+H2O=2NaHCO3,由方程式可知2molNa2CO3消耗2molCO2,故剩余1molCO2,故溶液中n(Na2CO3)=0mol,生成NaHCO3为2mol;
由气体全部被吸收,故酸性HX<H2CO3,还发生反应NaX+CO2+H2O=HX+NaHCO3,则:
? NaX+CO2+H2O=HX+NaHCO3,
1mol? 1mol? 1mol
故1mol反应消耗1molNaX,生成1molNaHCO3,
所以溶液中n(NaX)=4mol-1mol=3mol,n(NaHCO3)=1mol+2mol+1mol=5mol,
故选A.
点评:考查混合物的计算,难度较大,为易错题,根据离子共存与二氧化碳没有剩余判断发生的反应是解题的关键.
本题难度:一般
3、选择题 把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2?2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 ;②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据二氧化碳是否过量用讨论的方法计算.
解答:2.24L混合气体的物质的量为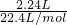 =0.1mol;
=0.1mol;
2.016LO2的物质的量为 =0.09mol.
=0.09mol.
2Na2O2+2CO2=2Na2CO3+O2 △n
2? 2? 1
n?m? 0.1mol-0.09mol=0.01mol
n=m=0.02mol,
1、若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2? Na2O2+4? HCl=4NaCl+2H2O+O2
0.16mol? 0.32mol?0.08mol
?NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol? 0.02mol
所以Na2O2为0.16mol,NaHCO3为0.02mol;混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
消耗的HCl为0.32mol+0.02mol=0.34mol,物质的量浓度为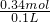 =3.4mol/L.
=3.4mol/L.
2、若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol? 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol-0.01mol=0.09mol.
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol?0.09mol
所以Na2O2为0.02mol,NaHCO3为0.09mol;混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
消耗的HCl为?0.04mol+0.09mol=0.13mol,物质的量浓度为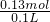 =1.3mol/L.
=1.3mol/L.
故选:D.
点评:本题考查混合物的计算,难度较大,关键是二氧化碳与过氧化钠的反应讨论进行计算.
本题难度:一般
4、选择题 除去SiO2中的少量Fe2O3,可以用
A.盐酸
B.氢氧化钠溶液
C.氧化钙
D.碳
参考答案:A
本题解析:正确答案:A,SiO2不与HCl反应,Fe2O3+6HCl=2FeCl3+3H2O。
本题难度:一般
5、选择题 常温下不能与浓氨水形成白烟的是
A.浓盐酸
B.浓硫酸
C.浓磷酸
D.浓硝酸
参考答案:BC
本题解析:不能与浓氨水形成白烟的是难挥发性酸。
本题难度:一般