微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的
A.滴加KI溶液时,转移2mol e-时生成1mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
参考答案:D
本题解析:溶液变为棕色,说明反应中有单质碘生成。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色,进一步验证了碘的存在。因为碘能把SO2氧化生成硫酸和碘化氢。因此硫酸铜和碘化钾反应的化学方程式是2CuSO4+4KI=2CuI↓+I2+2K2SO4,所以转移2mol e-时生成2mol白色沉淀,A不正确;B不正确,体现的是SO2的还原性;C不正确,单质碘是氧化剂;根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,选项D正确,答案选D。
点评:凡是有元素化合价升降的反应都是氧化还原反应,所以准确标出有关元素的化合价变化情况,是判断的根本。而氧化还原反应中的计算,则需要依据电子的得失守恒进行。
本题难度:一般
2、填空题 (5分)在 K2Cr2O7 +? HCl ——? KCl +? CrCl3 +? Cl2↑+? H2O反应中。
(1)氧化剂是?,?元素被氧化,氧化产物是?。
(2)在参加反应的盐 酸中,被氧化的HCl与未被氧化的HCl的质量比为?.
酸中,被氧化的HCl与未被氧化的HCl的质量比为?.
(3)如果反应生成0.1molCl2,则转移电子的数目为:
参考答案:(每空1分,共5分)(1)K2Cr2O7,盐酸中-1价的氯元素,Cl2
(2)3∶4?(3)1.204×1023
本题解析:略
本题难度:一般
3、选择题 下列化学反应属于图中区域③的是
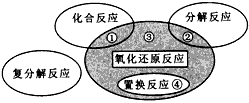
[? ]
A.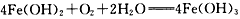
B.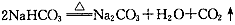
C.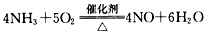
D.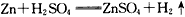
参考答案:C
本题解析:
本题难度:简单
4、选择题 在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是(?)
①FeCl2、②FeCl3、③I2、④Br2、⑤Fe(OH)3、⑥Fe2O3、⑦FeO。
A.①③④
B.③I2⑦
C.③⑤
D.⑥
参考答案:D
本题解析:氯气过量,则反应中生成氯化铁、单质溴和碘。加热时溴挥发,碘也可以升华,氯化铁存在水解平衡,加热促进水解,最终得到氢氧化铁。氢氧化铁灼烧得到氧化铁,答案选D。
本题难度:一般
5、选择题 已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+;且知100mL c(A2On2-)=0.3mol/L的溶液与150mL c(B2-)=0.6mol/L的溶液恰好完全反应,则n值为(?)
A.4
B.5
C.6
D.7
参考答案:D
本题解析:根据得失电子守恒有0.1L×0.3mol/L×2×(-3)=0.15L×0.6mol/L×2。解得n=7。
本题难度:简单