微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g);△H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g);△H1="156.6" kJ·mol-1
CH3CH=CH2(g) ?CH4(g)+HC=CH(g);△H2="32.4" kJ·mol-1
?CH4(g)+HC=CH(g);△H2="32.4" kJ·mol-1
则相同条件下,反应C3H8(g) ?CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
?CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3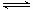 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_______________________(用离子方程式和必要的文字说明)。
参考答案:(1)124.2。
(2)C3H8+5O2 3CO2+4H2O;负。
3CO2+4H2O;负。
(3)4.2×10-7 mol·L-1。
(4)> ;HCO3-+H2O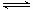 CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3-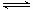 CO32-+H+)。
CO32-+H+)。
HCO3-+H2O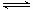 H2CO3+OH-、HCO3-的水解程度大于电离程度
H2CO3+OH-、HCO3-的水解程度大于电离程度
本题解析:(1)由盖斯定律可知,由上一个反应减去下一个反应:C3H8(g)===CH3CH=CH2(g)+H2(g) 得:△H=124.2kJ·mol-1。
(2)注意电池反应不是电极反应,这是本题的关键。电池反应为:C3H8+5O2===3CO2+4H2O,由于CO32-为阴离子,所以它应向负极移动。
(4)由于0.1 mol·L-1NaHCO3溶液的pH大于8,说明溶液呈碱性,进一步推测可知,HCO3-的水解大于HCO3-的电离。
本题难度:一般
2、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、Cl-、Na+
B.c(H+)=1.0×10-13?mol?L-1溶液中:C6H5O-、K+、SO42-、Br-
C.Na2S溶液中:SO42-、K+、Cl-、Cu2+
D.能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3-
参考答案:B
本题解析:分析:A.pH=1的溶液,显酸性,离子之间发生氧化还原反应;
B.c(H+)=1.0×10-13?mol?L-1溶液,显碱性;
C.离子之间结合生成沉淀;
D.能使甲基橙呈红色的溶液,显酸性,pH<3.1.
解答:A.pH=1的溶液,显酸性,Fe2+、NO3-、H+离子之间发生氧化还原反应,则不能共存,故A错误;
B.c(H+)=1.0×10-13?mol?L-1溶液,显碱性,该组离子之间不反应,能共存,故B正确;
C.S2-、Cu2+离子之间结合生成沉淀,则不能共存,故C错误;
D.能使甲基橙呈红色的溶液,显酸性,pH<3.1,H+、HCO3-结合生成水,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确习题中的信息及信息的应用是解答的关键,注意离子之间的氧化还原反应为解答的难点,题目难度不大.
本题难度:一般
3、选择题 现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 | Na+? H+? Ba2+?
|
| 阴离子 | OH–?CO32–? SO42–?
|
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体,少量的该气体可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于B溶液;
请根据上述实验结果,选择:
(1)现有A、B、C三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,如果出现沉淀则过滤,再将滤液与第三种溶液混合起来,最终所得的溶液_____为酸性A 、可能? B 、不可能 写出最终所得的溶液碱性的混合顺序_________。
参考答案:B
本题解析:试题分析:
本题难度:简单
4、选择题 能正确表示下列反应的离子方程式是
A.用铜片作阴、阳极电解硝酸银溶液:4Ag++2H2O4Ag+O2↑+4H+
B.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++2H2O+NO↑
C.向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2Cl-+I2
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
参考答案:D
本题解析:分析:A、铜做电极时阳极发生反应是铜失电子发生氧化反应,溶液中的银离子得电子发生还原反应;
B、离子方程式中的电荷不守恒,转移电子不守恒;
C、混合溶液中亚硫酸根离子和碘离子的还原性不同,氧化还原反应先氧化还原性强的离子;
D、等物质的量酸式盐和碱反应依据氢离子和氢氧根离子的反应实质分析判断.
解答:A、用铜片作阴、阳极电解硝酸银溶液阳极电极反应是Cu-2e-=Cu2+,阴极反应为:2Ag++2e-=2Ag,电池反应为Cu+2Ag+=2Ag+Cu2+,故A错误;
B、足量铁与稀硝酸反应:3Fe+8H++2NO3-=3Fe2++4H2O+2NO↑,故B错误;
C、溶液中离子的还原性SO32->I-,通入少量氯气先氧化亚硫酸根离子,离子方程式为:Cl2+SO32-+H2O=SO42-+2H++2Cl-,故C错误;
D、等物质的量的Ba(OH)2与NaHSO4在溶液中反应的离子方程式为:Ba2++OH-+SO42-+H+=BaSO4↓+H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写原则和注意问题,主要是电解池中的反应离子方程式书写,氧化还原反应的顺序氧化,关键是电解时阳极是活性电极时,电极本身失电子发生氧化还原反应.
本题难度:一般
5、选择题 下列说法错误的是
A.对羟基苯甲酸的沸点比邻羟基苯甲酸高,冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的,面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性,形成氢键的三个相关原子可以不在直线上
D.金属晶体的导电、导热性都与自由电子有关,离子晶体在一定条件下可以导电
参考答案:C
本题解析:H-H键没有方向性,故C错误;ABD均正确。
本题难度:简单