微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在相同温度和压强下,1体积气体X2和3体积气体Y2化合成2体积气体Z,则Z的分子组成为
A.XY
B.X3Y
C.XY3
D.X2Y3
参考答案:C
本题解析:分析:在相同温度和压强下,体积之比等于物质的量之比等于化学计量数之比,然后利用原子守恒来确定Z的化学式.
解答:在相同温度和压强下,1体积气体X2和3体积气体Y2化合成2体积气体Z,
由体积之比等于物质的量之比等于化学计量数之比,
可知X2+3Y2═2Z,
根据原子守恒可知,反应前后X、Y的原子个数相等,
则Z的化学式为XY3,
故选C.
点评:本题考查阿伏伽德罗定律,明确同温度同压强,体积之比等于化学计量数之比是解答本题的关键,并注意质量守恒定律的应用来解答,难度不大.
本题难度:困难
2、选择题 在一定条件下,可与甲烷发生反应的是
A.氧气(光照)
B.氯气(加热)
C.高锰酸钾酸性溶液(常温)
D.浓硫酸(常温)
参考答案:B
本题解析:常温下甲烷性质稳定,与浓硫酸、高锰酸钾酸性溶液不发生反应.常温和光照条件下,氧气不能与甲烷发生反应.加热条件下氯气能与甲烷发生反应.
本题难度:简单
3、选择题 下列各组物质间,不能发生反应的是
A.二氧化硅与氧化钙(高温)
B.二氧化硅与氢氧化钠(常温)
C.二氧化硅与碳(高温)
D.二氧化硅与浓硝酸(常温)
参考答案:D
本题解析:在高温下SiO2能被C还原.在众多的酸中能与SiO2反应的只有氢氟酸.
本题难度:一般
4、选择题 实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
A.950mL 111.2g
B.500mL 117.0g
C.任意规格 111.2g
D.1000mL 117.0g
参考答案:D
本题解析:分析:容量瓶的规格为:50,100 mL、250 mL、500 mL和1000 mL等多种.因此只能配制一定体积的溶液,没有950mL的容量瓶,可配制1000mL 2mol/L的NaCl溶液,取出950mL使用.计算溶质时也按1000mL来计算.
解答:配制2mol/L的NaCl溶液1000mL需氯化钠的质量为:2mol/L×1L×58.5g/mol═117.0g.
故选D.
点评:只能配制容量瓶上规定体积的溶液,不能配制任意体积的一定物质的量浓度的溶液.计算时也要按配制的体积来计算所需溶质.
本题难度:困难
5、选择题 相同质量的SO2和SO3之间的关系是
A.所含氧元素的质量之比为5:6
B.所含S元素的质量之比为4:5
C.所含氧原子的物质的量之比为3:2
D.所含S原子的物质的量之比为1:1
参考答案:A
本题解析:分析:令相同质量的SO2和SO3的质量为1g,根据n=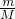 计算二者的物质的量;
计算二者的物质的量;
A、SO2分子中含有2个氧原子,SO3分子中含有3个氧原子,计算含有氧原子的物质的量,再根据m=nM可知氧元素质量之比等于氧原子物质的量之比;
B、SO2和SO3分子都含有1个硫原子,计算硫原子的物质的量,再根据m=nM可知硫原子质量之比等于硫原子物质的量之比;
C、SO2分子中含有2个氧原子,SO3分子中含有3个氧原子,据此计算氧原子物质的量;
D、SO2和SO3分子都含有1个硫原子,S原子的物质的量之比等于二者物质的量之比.
解答:令SO2和SO3的质量为1g,则SO2的物质的量为 =
=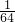 mol,SO3的物质的量为
mol,SO3的物质的量为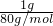 =
=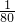 mol,
mol,
A、相同质量的SO2和SO3的所含氧元素的质量之比为: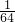 mol×2:
mol×2: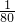 mol×3=5:6,故A正确;
mol×3=5:6,故A正确;
B、相同质量的SO2和SO3的所含硫原子的质量之比为: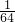 mol:
mol: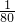 mol=5:4,故B错误,
mol=5:4,故B错误,
C、SO2分子中含有2个氧原子,SO3分子中含有3个氧原子,同质量的SO2和SO3的所含氧原子物质的量之比为: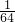 mol×2:
mol×2: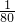 mol×3=5:6,故C错误;
mol×3=5:6,故C错误;
D、SO2和SO3分子都含有1个硫原子,相同质量的SO2和SO3的所含硫原子的物质的量之比为: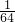 mol:
mol: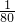 mol=5:4,故D错误;
mol=5:4,故D错误;
故选A.
点评:考查物质的量、常用化学计量的有关计算,难度不大,注意对公式的理解与灵活运用.
本题难度:一般