微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是(?)
?
A.X,Y,Z中X的单质最稳定?B.Y的氢化物为HY
C.X能生成HXO? D.能发生Cl2+H2Z=Z+2HCl的反应
参考答案:C
本题解析:关键短周期元素X,Y,Z在周期表中的相对位置可知,X是He,Y是F,Z是S。He是稀有气体分子,单质最稳定,A正确;F的最低价是-1价,氢化物是HF。稀有气体元素一般不能形成化合物,C不正确;氯元素的非金属强于S元素的,则可以发生置换反应Cl2+H2Z=Z+2HCl,D正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:简单
2、填空题 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为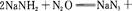

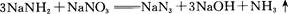 回答下列问题:
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是?,第一电离能最小的元素是?。
(2)基态氮原子的L层电子排布图为?。
(3)与N3-互为等电子体的分子为?(写出一种)。依据价层电子对互斥理论,NO3-的空间构型为?。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为?。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:?。
(5)N20沸点(一88.49℃比NH3沸点(一33.34℃)低,其主要原因是?
(6)安全气囊的设计原理为
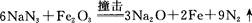
①氮分子中δ键和π键数目之比为?。
②铁晶体中存在的化学键类型为?。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为
?(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。

参考答案:22. (1)氟(或F)?锂(或Li)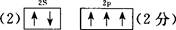
(3)CO2或N2O?平面三角形
(4)离子晶体(1分)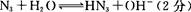
(5)氨分子间存在氢键?(6)1:2?金属键?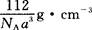
本题解析:(1)氮元素在第二周期,同周期,从左向右电负性依次增大(稀有气体除外),故为氟;第一电离能逐渐增大,故最小的为锂;(2)氮原子L层上有5个电子,先排s上的2个电子,再排p上的三个电子;(3)N3-价电子总数为16,等电子体的为价电子总数相等的CO2或N2O;先算出孤电子对数为(5+1-2×3)/2=0,成键电子对为3,故为sp2杂化,故为平面三角形;(4)两者均含有钠离子和阴离子,故为离子晶体,盐溶液显碱性为阴离子水解,故为N3-结合水电离出的氢离子生成氨气和氢氧根离子;(5)氨气分子能形成分子间氢键,沸点升高;(6)①氮气中形成氮氮三键,有一条δ键和2条π键,故为1:2;②铁为金属晶体,存在金属键;③晶胞的体积为a3,有8个铁原子位于顶点,一个位于中心,故晶胞完全占有的铁原子数目为2个,质量为 ×2g,质量除以体积得密度。
×2g,质量除以体积得密度。
本题难度:一般
3、选择题 230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A.Th 元素的质量数是232
B.Th 元素的相对原子质量是231
C.232Th 转换成233U是化学变化
D.230Th和232Th的化学性质几乎相同
参考答案:D
本题解析:A、钍的两种核素230Th和232Th,其质量数分别是230,232,故A错误;B、元素的相对原子质量是按各种天然同位素原子所占的百分比计算出来的平均值,在不知道各种天然同位素原子所占的百分比的情况下不能求得其平均值,故B错误;C、化学变化是生成新物质的变化,原子种类不变,而232Th 转换成233U 时原子种类发生了变化,故C错误;D、同位素的物理性质可以不同,但化学性质几乎相同。故D正确。
本题难度:一般
4、填空题 (12分)短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示:
请回答下列问题:
⑴B、C、D元素的原子半径的大小顺序为:________>________>________(填元素符号)。
⑵E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为______________________________________________。
⑶C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L甲气体与0.5 L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是________。
⑷在298K下,A、B的单质各1mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3mol B的单质,则该反应在298K下的ΔH=?(注:题中所设单质均为最稳定单质)
⑸要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是?。
⑹用A、B的单质作电极,C的最高价氧化物的水化物稀溶液作电解质溶液构成原电池,写出此原电池正极的电极反应式?。(假设C只被还原至+2价)
参考答案:(12 分):(1)C>N>O
分):(1)C>N>O
(2)8HCl+KClO4KCl+4Cl2↑+4H2O
(3)NaNO2
(4)-(4a-3b)kJ/mol或(3 b-4a)kJ/mol
b-4a)kJ/mol
(5)将氯水(或氯气)滴入(通入)到硫化钠(或硫化氢等)溶液中,有淡黄色沉淀生成。
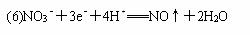
本题解析:略
本题难度:一般
5、选择题 短周期元素W、X、Y、Z在元素周期表中的位置如右图所示。下列说法中,正确的是
?
A.Y的原子半径在同周期主族元素中最大
B.W的最高价氧化物对应的水化物是强酸
C.X原子最外层电子数为8
D.Z的气态氢化物的稳定性在同主族元素中最强
参考答案:B
本题解析:根据元素在周期表中的相对位置可知,X应该是He,Y应该是F,Z应该是S,W应该是Cl。A不正确,同周期自左向右,原子半径逐渐减小;高氯酸是已知含氧酸中酸性最强的,B正确;X原子最外层电子数为2,C不正确;非金属性越强,氢化物的稳定性越强,同主族自上而下非金属性逐渐降低,所以D不正确,第ⅤA族元素中水的稳定性最强,答案选B。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。本题基础性较强,重点突出。
本题难度:简单