微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.元素性质随着相对原子质量的递增而呈周期性的变化叫元素周期律
B.同周期第ⅡA族与第IIIA族的元素原子序数之差可能为1、11或25
C.在周期表中ⅠA族处寻找催化剂和耐高温的合金材料
D.第三周期元素的离子半径,从左到右逐渐减小
参考答案:B
本题解析:元素的性质随着原子序数的递增而呈现周期性的变化,叫元素周期律,A不正确由于从第四周期开始出现副族和第Ⅷ,且在第ⅢB中含有镧系和锕系,所以B正确。在过渡元素中寻找催化剂和耐高温的合金材料,C不正确。第三周期元素的阴离子半径大于阳离子半径,D不正确,答案选B。
本题难度:简单
2、选择题 同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZ0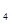 >H
>H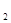 Y0
Y0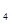 >H
>H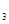 X0
X0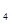 ,下列判断正确的是(?)
,下列判断正确的是(?)
①阴离子的还原性按X、Y、Z顺序减弱?②单质的氧化性按X、Y、Z顺序增强
③非金属性按X、Y、Z顺序增强?④气态氢化物的稳定性按X、Y、Z顺序减弱
A.①②④
B.②③
C.①②③
D.①②③④
参考答案:C
本题解析:同周期自左向右,非金属性逐渐增强,最高价氧化物的水化物酸性逐渐增强,所以根据题意可知,非金属性是Z>Y>X。非金属性越强,相应氢化物的稳定性越强,相应阴离子还原性逐渐减弱,所以选项①②③正确,④不正确,答案选C。
本题难度:一般
3、选择题 不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
参考答案:B
本题解析:A、根据同主族金属元素原子半径大小,可以推出原子核对最外层电子的吸引能力强弱,进而可知失电子能力强弱,正确;B、1 mol金属单质在反应中失去电子的多少与金属失电子能力没有直接关系,错误;C、活泼金属可以与不活泼金属的盐溶液发生置换反应,生成不活泼金属单质,正确;D、金属元素最高价氧化物对应水化物的碱性越强,金属失电子能力越强。
本题难度:一般
4、填空题 (1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式?。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
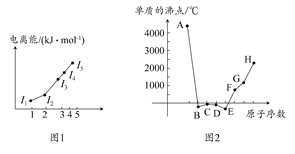
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有σ键又含有π键的是?(填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示)?。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为?。
④原子序数比A小1的元素与D元素形成的化合物的空间构型为?,中心原子的杂化方式为?。
参考答案:(1)1s22s22p63s2
(2)①N2、O2?②F>N>O?③极性共价键?④平面三角形? sp2
本题解析:(1)根据图1中X的前五级电离能,从其第三电离能开始突增,因此其最外层有两个电子,故X为Mg(注意Be原子只有4个电子,没有第五电离能),其基态原子的核外电子排布式为1s22s22p63s2。
(2)根据图2中元素单质的沸点,可知A、B、C、D、E、F、G、H为C、N、O、F、Ne、Na、Mg、Al。①单质形成的晶体为分子晶体的有N2、O2、F2、Ne等,其中N2、O2中既含有σ键又含有π键。②B、C、D三种元素分别为N、O、F,第一电离能大小顺序为:F>N>O(注意N、O电离能反常)。③Al、Cl形成的化合物为AlCl3,根据其化合物的物理性质,可以推断其含有共价键。④原子序数比A小1的元素为N,与F元素可形成化合物NF3,为平面三角形结构,中心原子N的杂化方式为sp2。
本题难度:一般
5、填空题 本题对应于“物质结构与性质”选修模块的内容。
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
Z
| ?
| ?
| ?
| ?
|
?
| ?
| M
| L
| Q
| R
| ?
| ?
|
D
| A
| ?
| ?
| T
| X
| Y
| ?
|
E
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| J
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
?
(1)Y分别与D、E形成的化合物中熔点较高是_________(用具体物质的化学式表示)。
(2)LX2分子的电子式是_________,MY3分子是_________(填“极性分子”或“非极性分子”)。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是__________________; J(LR)4固态时属于_________晶体(填晶体类型)
(4)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最?
高记录。右图中所示的是该化合物的晶体结构单元。图中上,下
底面中心“Δ”处的原子是_______(填元素符号)。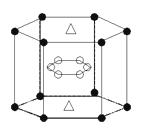
参考答案:(1)? NaCl?
(2) ____?略??__非极性分子??
(3)? [Ar]3d84s2??__分子?
(4)? Mg?
本题解析:略
本题难度:一般