微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)在下列反应中,用序号填空:
A.2F2+2H2O=4HF+O2?B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2?D.2H2O
2H2↑+O2↑
水只作氧化剂的是______,水只作还原剂的是______,水既作氧化剂又作还原剂的是______,水既不作氧化剂又不作还原剂的是______.
(2)用“双线桥法”表示下列反应中电子转移的方向和总数.
Fe2O3+3CO2Fe+3CO2
(3)用“单线桥法”表示下列反应中电子转移的方向和总数
Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
(4)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O?6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.
参考答案:(1)A中F元素的化合价降低,O元素的化合价升高,则水只作还原剂;
B中Na元素的化合价升高,H元素的化合价降低,则水只作氧化剂;
C中各元素的化合价都没有发生变化,属于非氧化还原反应,则水既不作氧化剂又不作还原剂;
D中H元素的化合价降低,O元素的化合价升高,则水既作氧化剂又作还原剂;
故答案为:B;A;D;C;
(2)在反应Fe2O3+3CO?高温?.?2Fe+3CO2中,Fe元素的化合价由+3降低为0,得2×3e-,C元素的化合价由+2升高到+4,失3×2e-,则
用“双线桥法”表示反应中电子转移的方向和总数为
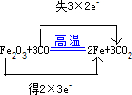
,答:用“双线桥法”表示反应中电子转移的方向和总数为

;
(3)在反应Cu+4HNO3(浓)?△?.?Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价由0升高到+2价,失2e-,N元素的化合价由+5价降低为+4价,得2×e-,则
用“单线桥法”表示反应中电子转移的方向和总数为
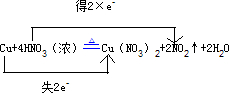
,
答:用“单线桥法”表示反应中电子转移的方向和总数为
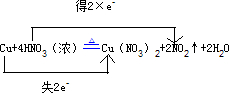
;
(4)Cu2S+2Cu2O?△?.??6Cu+SO2↑中6个Cu原子得到电子,1个S原子失去电子,该反应中的还原产物为Cu,氧化产物为SO2,其物质的量之比为6:1,
则反应中氧化产物与还原产物的质量比为6mol×64g/mol:1mol×64g/mol=6:1,故答案为:6:1.
本题解析:
本题难度:一般
2、选择题 对于2NaBr+Cl2═2NaCl+Br2反应,下列说法不正确的是( )
A.该反应既是置换反应,又是氧化还原反应
B.Cl2是氧化剂,发生还原反应
C.若有1.6gBr2生成,反应过程中转移了0.02NA个电子
D.钠元素在反应中价态不变,所以NaBr既不是氧化剂,又不是还原剂
参考答案:A、反应符合置换反应和氧化还原反应的概念,故A正确;
B、氯气化合价降低做氧化剂被还原,故B正确;
C、1.6gBr2物质的量为0.01mol,Br2~Br-~2e-反应过程中转移了0.02NA个电子,故C正确;
D、钠元素在反应中价态不变,但溴元素化合价变化,所以NaBr是还原剂,故D错误;
故选D.
本题解析:
本题难度:简单
3、选择题 据新华社电2009年12月5日零时20分,一辆装载黑火药的江西籍大货车行驶至京珠高速湖北段时起火爆炸,造成现场4人死亡,高速路面严重损毁.黑火药爆炸过程中发生反应的化学方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑.下列说法正确的是( )
A.每生成55?g?K2S转移电子数为6.02×1023
B.S和KNO3均为还原剂
C.反应过程中氮元素被还原
D.CO2为还原产物
参考答案:A.n(K2S)=55g110g/mol=0.5mol,消耗1.5molC,转移电子的物质的量为1.5mol×4=6mol,转移电子的数目为6×6.02×1023,故A错误;
B.N和S元素化合价降低,被还原,S和KNO3为氧化剂,故B正确;
C.反应过程中N元素的化合价降低,被还原,故C正确;
D.C元素化合价升高,被氧化,C为还原剂,CO2为氧化产物,故D错误.
故选C.
本题解析:
本题难度:简单
4、简答题 氧化还原反应是重要的一类化学反应.
(1)在化学反应2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2+8H2O中,化合价降低的元素是______,发生氧化反应的物质是______.
(2)据反应8NH3+3Cl2═6NH4Cl+N2回答下列问题:
①该反应中,氧化剂是______,还原剂是______.
②该反应中,当有8mol?NH3反应时,转移电子总量是______mol.
③参加反应的氧化剂与还原剂的物质的量之比为______(最简整数比).
④当有3mol?e-转移时,该反应生成的氧化产物的质量是______g.
参考答案:(1)2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2+8H2O中,Mn元素的化合价由+7价降低为+2价,I元素的化合价由-1价升高为0,则化合价降低的元素是Mn(或锰),KI作还原剂,发生氧化反应,
故答案为:Mn(或锰);KI(或碘化钾);
(2)8NH3+3Cl2═6NH4Cl+N2中,N元素的化合价由-3价升高为0,Cl元素的化合价由0降低为-1,
①由元素的化合价变化可知,Cl2为氧化剂,NH3为还原剂,故答案为:Cl2;NH3;
②8molNH3反应时只有2mol作还原剂,该反应中转移电子为2mol×[0-(-3)]=6mol,故答案为:6;
③由反应可知,3molCl2与2molNH3转移的电子数相等,则参加反应的氧化剂与还原剂的物质的量之比为3:2,故答案为:3:2;
④还原产物为氮气,6mol电子转移生成1molN2,则有3mole-转移时生成0.5molN2,其质量为0.5mol×28g/mol=14g,故答案为:14.
本题解析:
本题难度:一般
5、简答题 已知盐酸参加的下列三个反应:
①CaCO3+2HCl═CaCl2+CO2↑+H2O?②Fe+2HCl═FeCl2+H2↑? ③MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是______,其中盐酸作还原剂的是______.
(2)上述反应说明盐酸具有______性,______性,______性.
参考答案:(1)①CaCO3+2HCl═CaCl2+CO2↑+H2O中,各元素化合价都不变,所以不是氧化还原反应,为复分解反应,
②Fe+2HCl═FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂,
③MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③;
(2)通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂,故答案为:酸;氧化;还原.
本题解析:
本题难度:一般