微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
外加条件
| 平衡移动方向
| C(OH -)
| C(CH3COO -)
|
升温
| ?
| 不填
| 不填
|
加水
| ?
| ?
| 不填
|
加盐酸
| 不填
| ?
| ?
|
加少量氢氧化钠固体
| 不填
| 不填
| ?
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
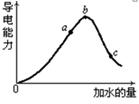
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是?。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
参考答案:(14分)、
(1)(每空1分)
外加条件
平衡移动方向
C(OH -)
C(CH3COO -)
升温
正向移动
?
?
加水
正向移动
增大
?
加盐酸
?
减小
减小
加少量氢氧化钠固体
?
?
增大
(2)(每空2 分)
①_? CH3COOH CH3COO + H+?。
CH3COO + H+?。
②__b>a>c__ 。
③? c?。
④C(H+)甲___小于 __ 10C(H+)乙
本题解析:略
本题难度:一般
2、选择题 下列叙述正确的是?(?)
A.0.1mol/L醋酸溶液中:c(H+) = c(CH3COO- ) +c(OH- )
B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者
C.由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4
D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3) >c(OH-)>c(H+)
参考答案:AB
本题解析:A 正确,遵循电荷守恒
B 正确,pH与体积都相同的硫酸和醋酸,醋酸的物质的量大于硫酸的物质的量,故消耗NaOH的量后者大于前者
C 错误,由水电离的H+浓度为1.0×10-4mol/L的溶液,pH等于4或者10
D 错误,NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)
本题难度:一般
3、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4-
B.遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl-
C.使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl-
D.0.1mol·L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3-