微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 随着卤素原子核电荷数的增加,下列递变规律正确的是
[? ]
A、单质的熔沸点逐渐降低
B、气态氢化物的稳定性逐渐减弱
C、卤素离子的还原性逐渐减弱
D、卤素单质的氧化性逐渐增强
参考答案:B
本题解析:
本题难度:一般
2、简答题 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息
A
A的单质是密度最小的物质
B
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子
C
C的原子最外层电子数是其内层电子数的三倍
D
D与B同周期,该周期中D的简单离子半径最小
E
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分
F
F元素最高正价与最低负价的代数和为4
|
(1)写出化合物Y所含的化学键名称______;
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)______;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式______;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为______;
(5)一定量的石灰乳中通入一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为______g,此时反应的化学方程式为______.
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠化合物.写出它与乙醇反应的化学方程式______.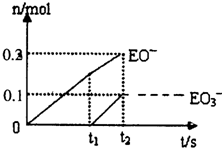
参考答案:(1)次氯酸钠中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子中氯原子和氧原子之间存在共价键,
故答案为:离子键、共价键(极性共价键);
(2)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半径随着原子序数的增大而减小,所以硫离子半径大于氯离子半径,
故答案为:S2->Cl->Al3+;
(3)硫酸氢钠溶液呈强酸性,亚硫酸氢钠是弱酸酸式盐,所以硫酸氢钠和亚硫酸氢钠反应产生硫酸钠、水和二氧化硫,
故答案为:H++HSO-3=SO2↑+H2O;
(4)铁和铝的混合物加入足量稀硫酸后生成硫酸亚铁和硫酸铝,向硫酸亚铁和硫酸铝溶液中加入过量氢氧化钠溶液后生成氢氧化亚铁沉淀和偏铝酸钠溶液,沉淀经洗涤、干燥、灼烧后得到一种固体是氧化铁,氧化铁的质量和铁与铝的混合物质量相等,所以铝的质量相当于氧元素的质量,所以铝的质量分数=16×316×3+56×2×100%=30%,
故答案为:30%;
(5)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
设需要氢氧化钙的质量为x.
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
? 740g? 2mol
? x? 0.1mol
x=37g
故答案为:37g;10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(6)氢化钠与乙醇反应生成乙醇钠和氢气,故答案为:NaH+CH3CH2OH=CH3CH2ONa+H2↑.
本题解析:
本题难度:一般
3、选择题 下列几组顺序排列不正确的是( )
A.沸点高低:HI>HBr>HCl>HF
B.热稳定性大小:HF>H2O>NH3>PH3
C.熔点高低:金刚石>食盐>金属钠>冰
D.微粒半径大小:Al3+>Na+>F-
参考答案:AD
本题解析:
本题难度:一般
4、选择题 丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是
①新制氯水久置后→浅黄绿色消失
②淀粉溶液遇碘化钾→蓝色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色
A.①②④⑤
B.②③④⑤
C.①④⑤
D.①②③④⑤
参考答案:C
本题解析:①氯水久置后,HClO分解,最终为盐酸溶液,则浅黄绿色消失,故①正确;②淀粉遇碘单质变蓝,为淀粉的特性,遇碘化钾不变色,故②错误;③浓硫酸具有脱水性,则蔗糖中加入浓硫酸搅拌最终为黑色,故③错误;④二氧化硫具有漂白性,则SO2通入品红溶液中使红色褪去,故④正确;⑤氨气的水溶液显碱性,则氨气通入酚酞溶液中,溶液变为红色,故⑤正确;
本题难度:一般
5、选择题 若aXm+与bYn-的核外电子排布相同,下列关系式正确的是
A.b=a-n+m
B.b=a-n-m
C.离子半径Xm+<Yn+
D.原子半径X<Y
参考答案:B
本题解析:试题分析:A、b= a-n-m,故错;C、离子半径Xm+<Yn-,故错;D、原子半径X>Y,故错。故选B。
考点:质子数、中子数、核外电子数及其相互联系
点评:本题考查离子的电子数计算,明确阳离子失去电子、阴离子得到电子及四种离子的核外电子数相同即可解答,较简单。
本题难度:困难