| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《有关氧化还原反应的计算》高频考点强化练习(2017年最新版)(二)
参考答案:B 本题解析:A、1.5molCu被氧化时,参加反应的硝酸的物质的量是1.5mol×8/3=4.0mol,被还原的硝酸占参加反应硝酸的1/4,所以被还原的硝酸的物质的量是1.0mol,错误;B、1.5molCu被氧化,则生成NO的物质的量是1.5mol×2/3=1.0mol,标准状况下的体积是22.4L,正确;C、Cu失去2个电子成为铜离子,所以1.5molCu被氧化,转移电子的物质的量是3.0mol,错误;D、根据A的计算,参加反应的硝酸的物质的量是4mol,错误,答案选B。 本题难度:一般 2、选择题 下列反应中,不属于氧化还原反应的是?( ) 参考答案:A 本题解析:凡是有元素化合价升降的反应是氧化还原反应,据此可知选项BCD都是氧化还原反应,A是复分解反应,不是氧化还原反应,答案选A。 本题难度:一般 3、选择题 24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 |
参考答案:B
本题解析:根据氧化还原反应得失电子总数相等,判断Cr元素在还原产物里的价态。
n(Na2SO3)=0.05mol·L-1×0.024L=0.0012mol,
n(K2Cr2O7)=0.02mol/L×0.02L=0.0004mol。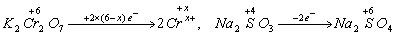
K2Cr2O7在反应中得电子:0.0004×2(6-x)mol e-;
Na2SO3在反应中失电子:0.0012×2mol e-。
根据氧化还原反应中,氧化剂和还原剂在反应中得失电子数相等,则有:
0.0004×2(6-x)=0.0012×2,解得x=3。此题选B。
考点:考查氧化还原反应中电子转移等相关计算。
本题难度:困难
4、选择题 H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为
A.0.224L
B.0.672L
C.0.112L
D.0.336L
参考答案:B
本题解析: H2SO4和HNO3的混合溶液中:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,
n(NO3-)=0.01L×2mol/L=0.02mol,所以根据方程式计算如下:
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
3 8 2
0.02mol 0.08mol 0.02mol
反应后剩余n(H+)=0.1mol-0.08mol=0.02mol,
Fe+2H+=Fe2++H2↑
2 1
0.02mol 0.01mol
所以:n(NO)+n(H2)=0.02mol+0.01mol=0.03mol,所得气体的体积为0.03mol×22.4L/mol=0.672L,
考点:考查硝酸的化学性质及混合物的计算。
本题难度:一般
5、选择题 化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的是
①用电子式表示HCl的形成过程: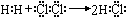 ,
,
②MgCl2的电子式: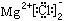 ,?
,?
③质量数为133、中子数为78的铯原子: Cs
Cs
④乙烯的结构简式CH2CH2,
⑤锌锰干电池在放电时正极上的电极反应式为:Zn→Zn2++2e-
A.①②③④⑤
B.④⑤
C.③④
D.③
参考答案:D
本题解析:①不正确,左侧应该是原子的电子式,正确的是 。氯化镁中氯离子的电子式不能合并,正确的是
。氯化镁中氯离子的电子式不能合并,正确的是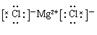 ,②不正确。乙烯的结构简式为CH2=CH2,④不正确。原电池中正极是得到电子的,负极是失去电子的,⑤不正确。所以正确的答案选D。
,②不正确。乙烯的结构简式为CH2=CH2,④不正确。原电池中正极是得到电子的,负极是失去电子的,⑤不正确。所以正确的答案选D。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《气体的制备.. | |