微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组酸中,酸性依次增强的是
[? ]
A. H2CO3、H2SiO3、H3PO4
B. HNO3、H3PO4、H2SO4
C. HI、HCl、H2S
D. HClO、HClO3、HClO4
参考答案:D
本题解析:
本题难度:简单
2、填空题 60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.试回答下列问题:
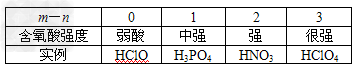
(1)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为________.
(2)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构________.
(3)按此规则判断碳酸应属于________酸,与通常认为的碳酸的强度是否一致?________.其可能的原因是___________________.
参考答案:(1)H3AsO4<H2CrO4<HMnO4 ?
(2)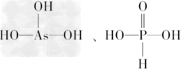
(3)中强 ;不一致 ;溶于水的那部分CO2并不能完全转化为H2CO3
本题解析:
本题难度:一般
3、选择题 进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是
A.SO2气体通过氯化钡与过氧化氢的混合溶液,有沉淀生成,表现了SO2的还原性
B.在含有Cu(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是Cu
C.纯净的金属钠放在空气中,颜色由银白色很快变暗,说明钠的化学性质比较活泼
D.常温下,将铝片放入浓硫酸中,无明显现象,说明铝与冷的浓硫酸不反应
参考答案:AC
本题解析:分析:A.二氧化硫和氯化钡不反应,二氧化硫和双氧水发生氧化还原反应生成硫酸根离子;
B.在金属活动性顺序表中,银离子氧化性大于铜离子;
C、放置在空气中的钠能被氧气氧化生成氧化钠;
D、常温下,铝和浓硫酸反应生成一层致密的氧化物阻止进一步的反应.
解答:A.亚硫酸的酸性小于盐酸,所以二氧化硫和氯化钡溶液不反应,二氧化硫具有还原性,双氧水具有强氧化性,所以二氧化硫能被双氧水氧化生成硫酸根离子,硫酸根离子和钡离子反应生成白色沉淀,所以能说明二氧化硫具有还原性,故A正确;
B.在金属活动性顺序表中,银离子氧化性大于铜离子,所以在含有Cu(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是银,故B错误;
C.纯净的钠放置在空气中很快变暗,原因是钠和氧气反应生成了氧化钠而使钠变暗,说明了钠的性质很活泼,故C正确;
D、常温下,铝和浓硫酸反应生成一层致密的氧化物阻止进一步的反应,而不是铝和浓硫酸不反应,故D错误.
故选AC.
点评:本题考查了元素化合物的性质,难度不大,易错选项是D,注意常温下,铝和铁能与浓硝酸、浓硫酸发生钝化现象,原因是生成一层致密的氧化物薄膜阻止了进一步的反应,而不是铁或铝与浓硝酸或浓硫酸不反应.
本题难度:一般
4、选择题 下列有关物质性质的比较中,正确的是
[? ]
①沸点:H2O>HCl>HF
②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4
④离子半径:O2->F->Na+
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:
本题难度:简单
5、选择题 无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH数),则n值越大,该酸的酸性就越强,硫酸、磷酸的结构如图。则它们的酸性
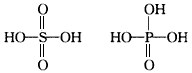
[? ]
A.硫酸和磷酸都是强酸
B.硫酸是强酸,但是酸性比磷酸弱
C.硫酸是强酸,且酸性比磷酸强
D.磷酸和硫酸都是弱酸
参考答案:C
本题解析:
本题难度:简单