微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示.已知达平衡后,降低温度,A的转化率将增大.
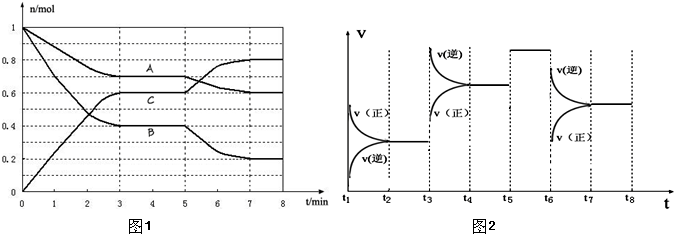
(1)根据图1数据,写出该反应的化学方程式______;此反应的平衡常数表达式K=______.从反应开始到达第一次平衡时的平均速率v(A)为______.
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______.
(3)图2表示此反应的反应速率v和时间t的关系图.
各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8
K1
K2
K3
K4
|
根据图2判断,在t3和t6时刻改变的外界条件分别是______和______;K1、K2、K3、K4之间的关系为:______(用“>”、<”或“=”连接).A的转化率最大的一段时间是______.
参考答案:(1)由图1可知,A、B为反应物,C为生产物,且最后A、B的物质的量不为0,为可逆反应,3min时△n(A):△n(B):△n(C)=(1-0.7)mol:(1-0.4)mol:0.6mol=1:2:2,物质的量之比等于化学计量数之比,所以反应方程式为A+2B
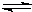
2C;
平衡常数为生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以k=c2(C)c(A)?c2(B)?;
从反应开始到达第一次平衡时的平均速率v(A)=(1-0.7)mol2L3min=0.05mol/(L?min),
故答案为:A+2B
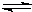
2C;c2(C)c(A)?c2(B)?;0.05mol/(L?min);
(2)K值不变,温度不变,由图1可知,5min时各组分的物质的量不变,且平衡向正反应移动,只能改变压强,
由反应为前后气体体积减小的反应,故应增大压强,故答案为:增大压强;
(3)降低温度,A的转化率将增大,反应向正反应进行,所以正反应为放热反应,该反应为前后气体体积减小的反应,
t3时刻,正逆反应速率都增大,且逆反应速率变化大,平衡向逆反应移动,应为升高温度,所以K1>K2;
t6时刻,正逆反应速率都减小,且正反应速率变化大,平衡向逆反应移动;应为降低压强,所以K3=K4;
t5~t6正逆速率都增大,平衡不移动,应是使用催化剂,k不变,所以K2=K3,所以K1>K2=K3=K4,所以t2~t3段A的转化率最高,
故答案为:升高温度;降低压强;K1>K2=K3=K4;t2~t3.
本题解析:
本题难度:一般
2、选择题 在一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为100,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( ? )
A.17%
B.5%
C.25%
D.33%
参考答案:A
本题解析:
本题难度:一般
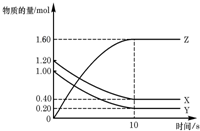
3、选择题 T℃时,在2L的密闭容器中,X、Y、Z三种气 体的物质的量随时间变化的曲线如图所示,下列描述正确的是( ? )
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1?L,平衡向正反应方向移动
C.T℃时,该反应的化学方程式为:X(g)+Y(g)?2Z(g),平衡常数K=40
D.向该密闭容器中充入少量稀有气体(不参加反应),平衡不移动