|
高中化学知识点总结《有关氧化还原反应的计算》试题巩固(2017年最新版)(二)
2017-08-01 00:27:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室用浓盐酸与二氧化锰制取氯气,收集到氯气0.224 L(折合成标准状况),则被氧化的HCl的物质的量是
A.0.02 mol
B.0.01 mol
C.0.04 mol
D.无法计算
|
参考答案:A
本题解析:由反应方程式可列关系式为:2HCl被氧化~Cl2,可得收集到氯气0.224 L(折合成标准状况),则被氧化的HCl的物质的量是n=0.224÷22.4×2=0.02mol,故A项正确;本题选A。
考点:化学计算。
本题难度:一般
2、选择题 下列化学用语表示正确的是? ( )。
A.Cl-的结构示意图:
B.甲烷分子的球棍模型:
C.氢氧化钠的电子式: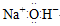
D.次氯酸的结构式:H—O—Cl
参考答案:D
本题解析:A项中核内质子数应为17;B项中给出的是甲烷分子的比例模型;C项中正确的电子式为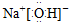 。 。
本题难度:简单
3、填空题 按要求写出下列反应的化学方程式
(1)铁在氯气中燃烧______.
(2)氯气水反应______.
(3)工业制取漂白粉______.
(4)实验室制取氯气______.
参考答案:(1)氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,故答案为:2Fe+3Cl2?点燃?.?2FeCl3;
(2)氯气能溶于水,生成盐酸和次氯酸,反应方程式为:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(3)工业上用氯气和熟石灰来制取漂白粉,原理是:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)实验室中用二氧化锰和浓盐酸加热来制取氯气,原理是:MnO2+4HCl?△?.?MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl?△?.?MnCl2+Cl2↑+2H2O.
本题解析:
本题难度:一般
4、简答题 在1Lamo1?L-1AlCl3溶液中加入1Lbmo1?L-1NaOH溶液
(1)当b≤3a时,生成Al(OH)3的物质的量为______mol;
(2)当a、b满足______条件时无沉淀生成;
(3)当a、b满足______条件时,b增大,沉淀量减少,此时生成沉淀的质量______g.
参考答案:已知反应:
AlCl3+3NaOH=Al(OH)3↓+3NaCl?
1?3
a?b?
AlCl3+4NaOH=NaAlO2+2H2O
?1?4?
?a?b?
当b=3a时刚好完全沉淀,b=4a时刚好无沉淀生成,
则(1)当b≤3a时,NaOH不足,NaOH完全反应生成Al(OH)3 沉淀,
生成Al(OH)3的物质的量为:n(Al(OH)3)=13n(NaOH)=b3mol,
故答案为:b3mol;
(2)由反应AlCl3+4NaOH=NaAlO2+2H2O可知,b≥4a时无沉淀产生,故答案为:b≥4a;
(3)由反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl、AlCl3+4NaOH=NaAlO2+2H2O,
可知:3a<b<4a时,先有沉淀产生后部分溶解,则
AlCl3+3NaOH=Al(OH)3↓+3NaCl?
a?3a?a
Al(OH)3↓+NaOH=NaAlO2+2H2O
1? 1
(b-3a)?(b-3a)?
所以最后剩余n(Al(OH)3 )=[a-(b-3a)]mol=(4a-b)mol,
m(Al(OH)3 )=(4a-b)mol×78g/mol=78×(4a-b)g=312ag-78bg
故答案为:312a-78b.
本题解析:
本题难度:一般
5、选择题 在反应:2H2S + SO2 = 3S↓ + 2H2O中,被氧化与被还原的硫原子数之比( )
A.1:1
B.1:2
C.3:2
D.2:1
|