微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是 (? )
A.2H++2e-=== H2
B.Fe2++2e-=== Fe
C.2H2O+O2+4e-=== 4OH-
D.Fe3++e-=== Fe2+
参考答案:C
本题解析:原电池中正极是得到电子的,所以钢铁发生吸氧腐蚀时,正极上发生反应的物质是氧气,因此正确的答案选C。
本题难度:简单
2、选择题 下列叙述中,正确的是:
A.电解池是将化学能转化为电能的装置
B.自发的氧化还原反应可设计为原电池的化学反应
C.金属的导电是物理变化,石墨和电解质溶液导电是化学变化
D.电镀过程相当于金属的“迁移”,可视为物理变化。
参考答案:B
本题解析:略
本题难度:简单
3、填空题 工业上处理含有Cr2O72-的酸性工业废水,通常有两种处理方法。第一种方法是:先加入绿矾(FeSO4·7H2O),把废水中的Cr2O72-还原成Cr3+离子,再加入过量的石灰水,使Cr3+转变为Cr(OH)3沉淀。第二种方法是:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极?,阴极?。
(2)Cr2O72-转变成Cr3+的离子反应方程式:?。
(3)采用第二种方法时,往工业废水里加入适量的NaCl的目的是?。
(4)能否用石墨电极来代替Fe电极??(填“能”或“不能”),简述理由:
?。
参考答案:(1)Fe-2e-=Fe2+(1分) 2H++2e-=H2↑(1分)
(2)6Fe2++ Cr2O72-+14H+ = 6Fe3++2Cr3++7H2O(2分)
(3)增强溶液(或废水)的导电性。(1分)
(4)不能,因为阳极不能产生能将Cr2O72-还原到Cr3+的Fe2+。(2分)
解析:由于Cr(Ⅵ)的化合物毒性远高于Cr(Ⅲ)化合物,将Cr(Ⅵ)转化为Cr(Ⅲ),对废水进行处理是电化学知识在实际生活中的具体运用。在处理有关问题时,应注意思维的有序性:首先应考虑,溶液中阴阳离子在外电场作用下的定向迁移;然后再考虑阴阳两极按放电顺序可能发生的电极方程式。阴极:2H++2e-=H2↑,阳极:Fe-2e-=Fe2+,产生的Fe2+在向阴极迁移的过程中与向阳极迁移的Cr2O72-相遇,发生氧化还原反应:6Fe2++ Cr2O72-+14H+ = 6Fe3++2Cr3++7H2O,使Cr2O72-转化为Cr3+,同时Fe2+也转化为Fe3+。在以上电解的阴极反应及Fe2+与Cr2O72-的氧化还原反应中都消耗了大量的H+,溶液的pH不断变大,有利于Fe3+,Cr3+生成相应的Fe(OH)3、Cr(OH)3沉淀。若将Fe电极改成为石墨电极,由于不能产生的Fe2+,而不能将Cr2O72-转化为毒性较低的Cr3+,显然是不行的。
本题解析:略
本题难度:一般
4、选择题 爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH-
③ 放电时,电解质溶液中的阴离子向负极方向移动
④ 放电时,负极上的电极反应式为:Fe+2H2O-2e-=Fe(OH)2+2H+
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.③
B.③④
C.④
D.①②⑤
参考答案:C
本题解析:①放电是原电池,由电池总反应式可知放电时Fe元素的化合价升高,被氧化,应为原电池的负极,NiO2参与正极反应,故①正确;②充电是电解池,由方程式可知此电池为碱性电池,反应方程式时不能出现H+,所以充电时阴极和阳极的电极反应式就分别为:Fe(OH)2+2e-=Fe+2OH-、2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故②正确;③放电时是原电池,负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-.电解质溶液中的阴离子向负极方向移动,故③错正确;④放电时是原电池,由方程式可知此电池为碱性电池,反应方程式时不能出现H+,负极:Fe-2e-+2OH-=Fe(OH)2,故④错误;⑤由方程式可知此电池为碱性电池,反应方程式时不能出现H+,只能浸在碱性电解质溶液中,故⑤正确,答案选C。
本题难度:一般
5、选择题 某小组为研究电化学原理,设计如图装置。下列叙述错误的是
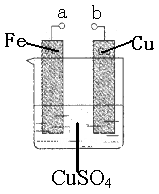
A.a和b不连接时,铁片质量会增加
B.a和b用导线连接时,正极发生的电极反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均被腐蚀
D.a和b分别连接电源正、负极时,Fe电极发生的电极反应为:4OH--4e-=2H2O+O2↑
参考答案:D
本题解析:
试题分析:A、a和b不连接时,铁与硫酸铜发生置换反应生成铜与硫酸亚铁。生成的铜附着在铁片上,因此铁片质量会增加,A正确;B、a和b用导线连接时构成原电池,铁的金属性强于铜,因此铁是负极,铜是正极,则正极发生的电极反应为:Cu2++2e-=Cu,B正确;C、a和b用导线连接时构成原电池,铁的金属性强于铜,因此铁是负极失去电子而被腐蚀。a和b不连接时,铁与硫酸铜发生置换反应生成铜与硫酸亚铁而被腐蚀,C正确;D、a和b分别连接电源正、负极时,构成电解池。Fe电极是阳极,失去电子,发生的电极反应为:Fe-2e-=Fe2+,D不正确,答案选D。
本题难度:一般