微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于可逆反应A(g) + 2B(g) 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是
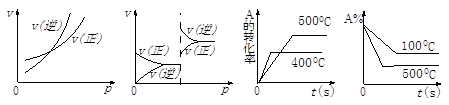
A? B? C? D
参考答案:D
本题解析:A、该反应是一个反应前后体积不变的反应,因此增大压强对正逆反应来讲是同等程度的改变大小,错误;B、错误跟A的原因一样;C、应该遵守“先拐先平,数值大”,错误;D、正确。
本题难度:一般
2、选择题 在恒温容器中,可逆反应?C(s)+H2O(g)?CO(g)+H2(g)一定达平衡状态的是( )
A.气体的压强不变
B.气体的体积不变
C.混合气的密度不变
D.有n个H-O键断裂的同时有n个H-H键断裂
参考答案:A、若在恒压容器中,压强不变不能证明达到平衡状态,故A错误;
B、恒容容器中体积不变,不能说明达到平衡,故B错误;
C、反应前后气体质量发生变化,体积变化的反应,恒容容器中、恒压容器中密度变化平衡变化,可以证明反应达到平衡,故C正确;
D、平衡需要正逆反应速率相同,应为有2n个H-O键断裂的同时有n个H-H键断时证明达到平衡,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 己知反应A(g) + B(g)  C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃
| 700
| 830
| 1200
|
K值
| 1.7
| 1.0
| 0.4
|
?
A.达到平衡后,B的转化率为50%
B.增大压强,正、逆反应速率均加快
C.该反应为吸热反应,升高温度,平衡正向移动
D.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1
参考答案:C
本题解析:设平衡时参加反应的B的物质的量为xmol,则:
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
开始(mol·L-1):0.2? 0.2? 0? 0
变化(mol·L-1):x? x? x? x
平衡(mol·L-1):0.2-x? 0.2-x? x? x
故 ?=1,解得x=0.1
?=1,解得x=0.1
所以平衡时B的转化率为 ×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)=
×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)=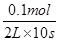 =0.005mol·L-1·s-1,故D正确,故选C。
=0.005mol·L-1·s-1,故D正确,故选C。
本题难度:一般
4、选择题 下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
化学式
电离常数
HClO
K1=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
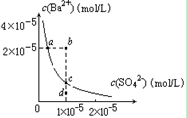
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数CKsp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。