微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
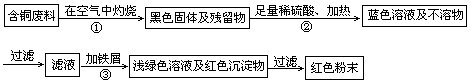
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:
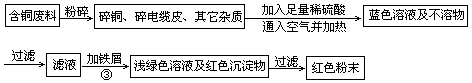
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①?;③?。
(2)从环保角度对两套方案的不同部分进行比较,你认为?(填“甲”或“乙”)方案更合理,理由是:?。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是:?。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法:?。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会?。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸?g,需水?mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的:?。
参考答案:(1)2Cu+O2 2CuO? Fe+CuSO4=FeSO4+Cu;(每个l分,共2分)
2CuO? Fe+CuSO4=FeSO4+Cu;(每个l分,共2分)
(2)乙(l分)甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;(2分,意思答对即可)
(3)将Cu完全置换出来,(2分)将所得铜粉酸洗后再洗涤、干燥;(2分)
(4)水污染或环境污染;(1分)
(5)4900(2分)3060(2分)将浓硫酸沿烧杯内壁缓缓加入水中,边加边搅拌。(2分)
本题解析:结合题中信息可以得出(1)、 (2)、 (3) 、(4)的答案。
(1)2Cu+O2 2CuO;Fe+CuSO4=FeSO4+Cu;;
2CuO;Fe+CuSO4=FeSO4+Cu;;
(2)乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;;
(3)将Cu完全置换出来;将所得铜粉酸洗后再洗涤、干燥;
(4)水污染或环境污染;
(5)能配制出这种稀硫酸xg,则xg×36.8%=1000mL×1.84g/mL×98%,x=4900:其中浓硫酸的质量为1840g,所以需加水3060g。
本题难度:一般
2、选择题 分离下列混合物,按溶解、过滤、蒸发顺序进行的是(?)
A.氧化铜、木炭
B.碳酸钙、氯化钠
C.硝酸钾、氯化钠
D.乙醇、水
参考答案:B
本题解析:考查物质的分离与提纯。选项A中都是不溶于水的,A不正确;碳酸钙不溶于水,而氯化钠能溶于水,选项B正确;选项中都易溶于水的,不正确;选项D中是液体,不能过滤,答案选B。
本题难度:一般
3、计算题 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

根据题意回答下列问题:
(1)固体X中主要含有?(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用?(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是?。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
?、过滤、?、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是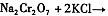
 。该反应在溶液中能发生的理由是:?。
。该反应在溶液中能发生的理由是:?。

(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量?(填写试剂)、溶解、过滤、再加入过量?(填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为?(用含m、n的代数式表示)。
参考答案:(15分)
⑴Fe2O3、MgO(2分);pH计或精密pH试纸(1分)。
⑵使CrO42-转化为Cr2O72-(3分)
⑶冷却结晶,洗涤(各1分)
⑷K2Cr2?O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2?O7的溶解度最小)。(2分)
⑸NaOH溶液、通入过量二氧化碳。(各1分)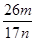 (3分)
(3分)
本题解析:⑴加热焙烧时FeO·Cr2O3、Al2O3、转化成了可溶性的Na2CrO4、NaAlO2,用水浸取后过滤,滤渣为MgO、Fe2O3;测pH是否等于4.5,应用pH计或精密pH试纸
⑵酸化步骤用醋酸调节溶液pH <5,其目的是使CrO42-转化为Cr2O72-。
⑶按操作的过程可看出差的两步是:冷却结晶,洗涤。
⑷K2Cr2?O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2?O7的溶解度最小)。
⑸依题意应先把氢氧化铝转化为可溶性的偏铝酸钠,过滤除杂质,再将偏铝酸钠转化为氢氧化铝,最后变为氧化铝m g。故先加过量NaOH溶液、再通入过量二氧化碳。氢氧化铝质量分数为(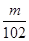 ×78×2) ÷n=
×78×2) ÷n=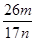
本题难度:困难
4、填空题 氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
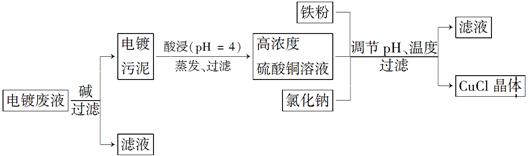
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
参考答案:(1)Cu(OH)2+2H+=Cu2++2H2O 3
(2)2Cu2++2Cl-+Fe=2CuCl↓+Fe2+
(3)加快乙醇和水的蒸发,防止CuCl被空气氧化?
(4)Na2SO4和FeSO4
不同温度下硫酸钠和硫酸亚铁的溶解度
(5)2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4
OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率
本题解析:(1)酸浸后可得到高浓度的硫酸铜溶液,所以发生的反应为Cu(OH)2+2H+=Cu2++2H2O;由图像知当pH=3时CuCl的产率最高。(4)反应中加入了Na+,反应后生成了Fe2+,所以滤液成分为Na2SO4和FeSO4。(5)将铁粉换成Na2SO3,则为+4价S还原Cu2+。
点拨:本题考查化学与技术,考查考生对化学与技术的掌握情况。难度中等。
本题难度:困难
5、选择题 下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是
?
| 物质
| 杂质
| 除杂试剂或操作方法
|
①
| 酒精
| 水
| 蒸馏
|
②
| H2
| CO2
| 通过盛有NaOH溶液洗气瓶,再通过盛有浓硫酸洗气瓶
|
③
| NaNO3
| CaCO3
| 溶解、过滤、蒸发
|
④
| NaCl
| I2
| 加热
|
⑤
| KNO3溶液
| AgNO3
| 加入NaCl溶液,过滤
|
?
A.①④⑤? B.③④⑤? C.①②③④? D.①②③⑤
参考答案:C
本题解析:①、酒精与水互溶,但沸点有差别,可用蒸馏法除水,正确;②、CO2能被NaOH溶液吸收,正确;③、CaCO3难溶于水,NaNO3易溶于水,正确;④、I2易升华,可用加热法除去I2,正确;⑤、加入NaCl溶液会引入新杂质Na+,错误,故C项正确。
本题难度:一般