微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
①?,②?,③?,④?,⑤?,⑥?。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出:?。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响:?,原因是:?。
参考答案:(1)①计算 ②称量 ③溶解 ④移液 ⑤洗涤 ⑥定容
(2)500 mL容量瓶?烧杯、玻璃棒、胶头滴管?
(3)偏小?溶液体积增大,溶质物质的量不变
本题解析:(1) 溶液配制步骤要记清楚;(2)配制溶液时需要的仪器要和步骤联系。如溶解用到烧杯和玻璃棒,转移溶液用到玻璃棒,定容用到胶头滴管。
(3)定容后,加盖倒转摇匀后,液面低于刻度线,是正常的,若加蒸馏水至刻度线,则溶液体积增大,而溶质的物质的量不变。所配溶液的浓度偏小。
本题难度:一般
2、选择题 等物质的量浓度的下列各溶液中,NH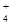 的浓度最大的是( )
的浓度最大的是( )
A.NH4HCO3
B.NH4HSO4
C.NH4Cl
D.NH3·H2O
参考答案:B
本题解析:在溶液中NH4+水解生成一水合氨,浓度降低。由于B中硫酸氢铵能电离出氢离子,抑制NH4+水解,浓度最大。一水合氨是弱碱,则D中NH4+浓度最小,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型。试题在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养,旨在提高学生的应试能力和学习效率。有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:简单
3、选择题 将Mg、Cu组成的2.64g混合物投入适量稀稍酸中恰好完全反应,并收集还原产物气体NO(还原产物只有一种)。然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下)体积为?(?)
A.8.96L
B.4.48L
C.0.896L
D.0.448L
参考答案:C
本题解析:根据题意可知金属的质量为2.64g,金属氢氧化物的质量为4.68g,可求出OH-的质量为2.04g,金属失1mol电子就结合1molOH-,因此OH-的量就是失电子的量,所以反应中失电子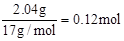 ,1molNO生成得3mol电子,根据得失电子数相等可求得NO的量为0.04mol,所以标准状况下,NO的体积为0.896L。答案选C。
,1molNO生成得3mol电子,根据得失电子数相等可求得NO的量为0.04mol,所以标准状况下,NO的体积为0.896L。答案选C。
点评:本题的关键就是找到金属结合OH-的量与转移电子数的关系。
本题难度:简单
4、选择题 NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,2.24L H2O含有的分子数等于0.1NA
B.常温下,100ml 1 moI·L-1Na2CO3溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4g NH3中含N—H键数目为0.2NA
参考答案:B
本题解析:标准状况下1mol任何气体(包括不反应的混合气体)所占体积约为22.4L,水在标准状况下为冰水混合物,A错;常温下,100ml 1 moI·L-1Na2CO3物质的量为1mol,由于CO32-会发生水解,溶液中阴离子总数大于0.1NA,B正确;C错,不是在标准状况下。1 moINH3中含3molN—H,3.4g NH3物质的量为0.2moI,N—H键数目为0.6NA
本题难度:简单
5、实验题 用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为?、?。
⑵该实验的实验步骤为:
①计算,②称量?gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度?;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度?;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度?;
④若定容时仰视刻度线。所配溶液的浓度?;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度?。
参考答案:⑴100 mL容量瓶?玻璃棒?⑵5.9?⑶①偏高?偏高?无影响?偏低 偏低
本题解析:(1)由于实验室没有95ml容量瓶,所以要用氯化钠固体配制1.00mol/L的NaCl溶液95mL,则需要100ml容量瓶,另外还缺少溶解和转移时的玻璃棒。
(2)需要氯化钠的质量=0.1L×1.00mol/L×58.5g/mol=5.85g≈5.9g。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。①用天平称量氯化钠后,发现砝码底部有锈斑,这说明砝码质量偏大,因此氯化钠的质量偏大,则所配溶液的浓度偏高;②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容,则冷却后容量瓶中溶液的体积偏少,因此所配溶液的浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对所配溶液的浓度不影响;④若定容时仰视刻度线,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低;⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低。
本题难度:一般