| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的量》高频试题特训(2017年最新版)(八)
参考答案:D 本题解析:A.c(Cl-)="c(KCl)=" 1mol/L;B. c(Cl-)="c(NaCl)=" 3mol/L;C. c(Cl-)=2c(MgCl2)=" 2×2mol/L=4" mol/L;D. c(Cl-)=3c(AlCl3)=" 3×1.5mol/L" ="4.5" mol/L,所以溶液中c(Cl-)最大的是4.5 mol/L,选项是D。 本题难度:一般 2、选择题 与100mL 0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是(? ) 参考答案:B 本题解析:根据硫酸铵的化学式可知,溶液中NH4+离子浓度是0.1mol/l×2=0.2mol/L。根据选项中的化学式可知,四个选项中NH4+离子浓度分别是(mol/L)2、0.2、0.4、0.1,答案选B。 本题难度:一般 3、选择题 欲配制100mL1.0mol/LNa2CO3溶液,正确的方法是 |
参考答案:BC
本题解析:A、水的体积为100mL,将10.6gNa2CO3溶于水后,溶于体积大于100mL,故溶液的浓度小于1mol/L,A错误;B、28.6g Na2CO3?10H2O物质的量为0.1mol,由化学式碳酸钠的物质的量等于碳酸钠晶体的物质的量为0.1mol,溶液体积为100ml,所配溶液浓度为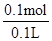 =1mol/L,B正确;C、令稀释后碳酸钠溶液浓度为c,根据稀释定律,稀释前后溶质碳酸钠的物质的量不变,则20ml×5mol/L=100ml×c,解得c=1mol/L,C正确;D、密度不同的溶液的体积不能直接相加,即20mL5.0mol/L Na2CO3溶液中加入80mL水,所得溶液的体积不是100mL,D错误。答案选BC。
=1mol/L,B正确;C、令稀释后碳酸钠溶液浓度为c,根据稀释定律,稀释前后溶质碳酸钠的物质的量不变,则20ml×5mol/L=100ml×c,解得c=1mol/L,C正确;D、密度不同的溶液的体积不能直接相加,即20mL5.0mol/L Na2CO3溶液中加入80mL水,所得溶液的体积不是100mL,D错误。答案选BC。
考点:考查配制一定物质的量浓度的溶液。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25°C时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
B.室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA
C.0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA
D.标准状况下,22.4LCCl4中含有的分子数目为NA
参考答案:B
本题解析:A、25°C时,1L pH=12的Ba(OH)2溶液中OH-的浓度是0.01mol/L,则溶液中含有的OH-数目为0.01NA,A不正确;B、乙烯和丁烯的最简式相同,都是CH2,所以室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键的物质的量= ×2=2mol,其数目为2.0NA,B正确;C、0.1mol Fe在0.1mol Cl2中充分燃烧,氯气不足,铁过量,因此转移的电子数为0.2NA,C不正确;D、标准状况下,四氯化碳不是气态,不能适用于气体摩尔体积,因此22.4LCCl4中含有的分子数目一定不是NA,D不正确,答案选B。
×2=2mol,其数目为2.0NA,B正确;C、0.1mol Fe在0.1mol Cl2中充分燃烧,氯气不足,铁过量,因此转移的电子数为0.2NA,C不正确;D、标准状况下,四氯化碳不是气态,不能适用于气体摩尔体积,因此22.4LCCl4中含有的分子数目一定不是NA,D不正确,答案选B。
本题难度:一般
5、选择题 已知某溶液中c(Na+)=0.2mol?L-1,c(Mg2+)=0.4mol?L-1,c(Cl-)=0.4mol?L-1,如果溶液中还有SO42-,那么c(SO42-)应为( )
A.0.1?mol?L-1
B.0.15?mol?L-1
C.0.3?mol?L-1
D.0.5?mol?L-1
参考答案:溶液中电荷守恒,故c(Na+)+2c(Mg2+)=c(Cl+)+2c(SO42-),所以
0.2mol?L-1+2×0.4mol?L-1=0.4mol?L-1+2c(SO42-),
解得:c(SO42-)=0.3?mol?L-1,
故选C.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《水的电离平.. | |