微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中沸点最低的是
A.己烷
B.新戊烷
C.异戊烷
D.3-甲基戊烷
参考答案:B
本题解析:考查烷烃的性质递变规律。烷烃分子中碳原子数越多,沸点越高。再碳原子数相同时,所含有的支链越多,沸点越低,因此新戊烷的沸点最低,答案选B。
本题难度:一般
2、填空题 化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。

①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
参考答案:(1)①N≡N 2NO3-+5H2 N2+2OH-+4H2O 0.001mol/(L·min)
N2+2OH-+4H2O 0.001mol/(L·min)
③加酸,升高温度,加水
(2)A, 2NO3-+6H2O+10e-=N2+12OH- ②14.4
本题解析: (1) ②废水不应显酸性(HNO3易挥发),而是中性或碱性,所以O2-在水中以H2O或OH-形式存在,有题意也可看出生成OH-(溶液pH由7变为12),依据氧化还原反应规律可配平:

pH=12 c(H+)=1×10-12mol·L-1
c(H+)=1×10-12mol·L-1
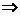 c(OH-)=
c(OH-)=  1×10-2mol·L-1
1×10-2mol·L-1
υ(NO3-)=υ(OH-)= 1×10-10mol·L-1 /10min= 0.001mol·L-1·min-1
③由方程式知NO2-+H2O HNO2+OH-△H>0 ,加热,加酸均可均可使平衡正向移动,促进NO2-转化。
HNO2+OH-△H>0 ,加热,加酸均可均可使平衡正向移动,促进NO2-转化。
(2)①2 O3-+10e-→
O3-+10e-→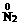 +6O2,所以B极为电源负极,A极为电源正极。
+6O2,所以B极为电源负极,A极为电源正极。
O2-+H2O=2OH-,可以写出阴极反应式:2NO3-+6H2O+10e-= N2↑+12OH-
② 左(+)阳极:4H2O(OH-)-4e-=4H++O2↑+2H2O
右(- )阴极:2NO3-+6H2O+10e-= N2↑+12OH-
10 e-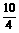 O2(左)- 1N2(右)-10H+
O2(左)- 1N2(右)-10H+
10mol 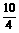 mol 1mol 10mol
mol 1mol 10mol
2mol 0.5mol 0.2mol 2mol
由于阴阳极之间被质子交换膜隔开,左侧电解产生的H+会穿过质子交换膜进入右侧,所以:
△m左=m(O2)+m(H+)=0.5mol×32g·mol-1+2mol×1g·mol-1="18g"
△m右= m(N2)-m(H+)=0.2mol×28g·mol-1-2mol×1g·mol-1=3.6g
△m左-△m右="18g-3.6g" = 14.4g
考点:电解原理及相关计算。
本题难度:一般
3、选择题 下列化学式只表示一种纯净物的是
A.C2H6O
B.C3H8
C.C2H4Cl2
D.C4H10
参考答案:B
本题解析:化学式只表示一种纯净物,说明不存在同分异构体。A可以是乙醇,也可能甲醚,B只能是丙烷,正确。C可以是1,1-二氯乙烷。也可能是1,2-二氯乙烷,D可以是正丁烷,也可能是是异丁烷,所以答案选B。
本题难度:简单
4、选择题 在标准状况下,气体A和B的密度分别为1.250 g·L-1,1.875 g·L-1,A、B的混合气体对H2的相对密度为16.8,则混合气体中A和B的体积比是
A.1∶1
B.1∶2
C.2∶3
D.3∶2
参考答案:D
本题解析:设A的物质的量是x,则n(B)为(1 mol-x)。
28x+42(1 mol-x)="33.6?" x="0.6" mol
n(A)="0.6" mol? n(B)="0.4" mol
n(A)∶n(B)=0.6∶0.4=3∶2。
本题难度:一般
5、选择题 下列物质属于纯净物的是
A.葡萄糖
B.聚乙烯
C.医用酒精
D.油脂
参考答案:A
本题解析:由一种物质组成的是纯净物,由不同种物质形成的是混合物,BCD都是混合物,葡萄糖是纯净物,答案选A。
本题难度:困难