微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量
A.等于2 mol
B.等于1 mol
C.小于1 mol
D.大于2 mol
参考答案:C
本题解析:略
本题难度:简单
2、选择题 图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
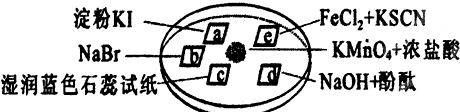
对实验现象的“解释或结论”正确的是( )
| 选项 | ?实验现象 | ?解释或结论
?A
?a处变蓝,b处变红棕色
?氧化性:Cl2>Br2>I2
?B
?c处先变红,后褪色
?氯气与水生成了酸性物质
?C
?d处立即褪色
?氯气与水生成了漂白性物质
?D
?e处变红色
?还原性:Fe2+>Cl-
|
A.A
B.B
C.C
D.D
参考答案:A、Cl2分别与KI、NaBr作用生成I2、Br2,a处变蓝、b处变橙色,可证明氧化性:Cl2>I2、Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,故A错误;
B、氯气与水反应Cl2+H2O=H++Cl-+HClO,H+使试纸变红,HClO具有漂白性,可使试纸褪色,则C处先变红,后褪色,能证明氯气与水生成了酸性物质和漂白性物质,故B错误;
C、Cl2和氢氧化钠反应生成氯化钠、次氯酸钠和水,消耗了氢氧化钠红色退去,不能证明生成物质具有漂白性,故C错误;
D、Cl2将Fe2+氧化为Fe3+,试纸变为红色,反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3,证明还原性Fe2+>Cl-,故D正确;
故选D.
本题解析:
本题难度:一般
3、填空题 某学习小组设计了如图所示的实验方案来探究氯气的性质.
(1)实验时甲同学在A装置中未加入任何试剂,发现B、C中的红色布条均褪色,由此甲同学得出结论:氯气具有漂白性.
实验时乙同学向A装置中加入了某种试剂,发现B中的红色布条不褪色而C中的红色布条褪色,由此乙同学得出结论:氯气没有漂白性.
你认为乙同学向A装置中加入的试剂是______,甲、乙同学的结论正确的是______.
(2)丙同学思考后认为上面的实验装置存在缺陷,并提出了解决方法.你认为存在的缺陷是______,解决方法为(用化学方程式表示)______.
(3)丁同学在A装置中加入滴有酚酞的NaOH溶液,观察到A装置中溶液红色逐渐褪去.他提出两种可能原因:①氯气与水反应生成次氯酸,次氯酸具有强氧化性将酚酞氧化使溶液褪色;②氯气与NaOH溶液反应使溶液褪色.请你帮助他设计一个简单的实验验证褪色的原因(简述实验步骤).______.
参考答案:(1)新制氯气中含有水蒸气,通过干燥布条也能褪色,应先加入浓硫酸干燥,干燥的有色布条不褪色,湿润的有色布条褪色的原因是氯气与水反应生成具有漂白性的HClO,
故答案为:浓硫酸;乙;
(2)氯气有毒,不能直接排放到空气中,应用NaOH溶液吸收,反应的化学方程式为Cl2+2HaOH=NaCl+NaClO+H2O,
故答案为:无尾气的吸收装置;Cl2+2HaOH=NaCl+NaClO+H2O;
(3)氯气与水反应生成次氯酸,次氯酸具有强氧化性,可使酚酞褪色,可向褪色后的溶液中加入NaOH溶液,观察到溶液是否变红色,如变红色,说明氯气与NaOH溶液反应使溶液褪色,否则为次氯酸具有强氧化性将酚酞氧化使溶液褪色,
故答案为:向褪色后的溶液中加入NaOH溶液,若观察到溶液变红色,说明褪色的原因为②;若溶液不变红色,说明褪色的原因为①.
本题解析:
本题难度:简单
4、选择题 下列有关实验现象的叙述,不正确的是( )
A.氢气在氯气中燃烧,发出苍白色火焰
B.铁丝在氯气中燃烧,生成红棕色烟
C.钠在氯气中燃烧,生成白色的烟
D.铜丝在氯气中燃烧,生成蓝色的烟
参考答案:铜在氯气中燃烧,可观察到有棕黄色的烟,生成氯化铜,其它选项正确.
故选D.
本题解析:
本题难度:一般
5、选择题 关于卤素的下列叙述正确的是(?)
A.卤素是典型的非金属元素,因此不能与其他非金属元素化合
B.卤素各单质都能与水发生剧烈反应
C.卤化银都是白色固体,既不溶于水,也不溶于稀硝酸
D.卤素单质都能与钠反应生成钠的卤化物
参考答案:D
本题解析:卤素是典型的非金属元素,能与很多其他非金属化合,如P等,A错。Cl2、Br2、I2与水均较微弱地反应;AgF溶于水,AgBr为不溶于酸的浅黄色沉淀,AgI为不溶于酸的黄色沉淀。B、C均错,D正确。
本题难度:简单