微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的组合是___________。
反应条件:①锌粒;②锌片;③锌粉;④5%盐酸;⑤10%盐酸;⑥15%盐酸;⑦加热;⑧用冷水冷却;⑨不断震荡;⑩迅速混合后静置。
欲使反应速率进一步增大,可采取的措施是(列举一条)_____________________。
参考答案:③⑥⑦⑨;滴入几滴硫酸铜溶液
本题解析:
本题难度:一般
2、选择题 在一可变容积的密闭容器中进行反应:C(s) + H2O(g)=" CO(g)" + H2(g),下列条件能使反应速率增大的是
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2,使体系的压强增大
D.保持压强不变,充入N2,使容器的体积变大
参考答案:B
本题解析:改变反应速率的因素有内因(决定性因素—反应物本身的性质)、外因(外界因素:如浓度、温度、压强、催化剂、光、超声波、电磁波等);
A错,增加C的量,反应的浓度不变,反应速率不变;
B正确,将容器的体积缩小一半,气体物质的浓度增大,化学反应速率增快;
C错,保持体积不变,充入N2,表面上压强增大,但体系中各组分的浓度不变,化学反应速率不变;
D错,保持压强不变,充入N2,使容器的体积变大,体系中各组分的浓度变小,反应速率减慢;
本题难度:一般
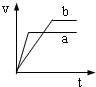
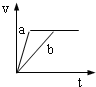
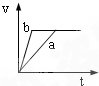
3、选择题 将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是( )
A.
B.
C.
D.
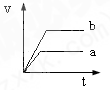
参考答案:由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,
且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有B图象符合,
故选B.
本题解析:
本题难度:简单
4、填空题 (6分)将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) 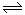 ?xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
?xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
(1)B的平均反应速率为?。
(2)x的值为?。
(3)5 min后,A、B的物质的量之比为?。
参考答案:
(1)0.05mol/(L·min)
(2)2
(3)3:5
本题解析:(1)5 min后,测得D的浓度为0.5 mol/L,则D的反应速率是0.5mol/L/5min="0.1" mol/(L·min),C的平均反应速率为0.1 mol/(L·min),根据反应速率之比等于化学计量数之比,所以x:2=1:1,所以x=2,B的平均反应速率是D反应速率的1/2,即0.1 mol/(L·min)×0.5=0.05mol/(L·min);
(2)根据以上分析x=2;
(3)5min后,消耗B的物质的量0.05mol/(L·min)×5min×2L=0.5mol,消耗A的物质的量是1.5mol,剩余A的物质的量是3mol-1.5mol=1.5mol,B剩余的物质的量是3mol-0.05mol/(L·min)×5min×2L=2.5mol,则5 min后,A、B的物质的量之比为1.5:2.5=3:5
本题难度:一般
5、填空题 (11分)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
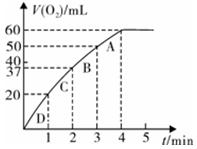
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。(2分)
②实验时放出气体的总体积是 mL。
③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为 min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。(2分)
⑥解释反应速率变化的原因 。(2分)
⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)(2分)
参考答案:
①2H2O2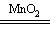 2H2O + O2↑;(2分)
2H2O + O2↑;(2分)
②60 mL ; ③1 min ; (各1分)
④2.5 min;(1分) ⑤D>C>B>A;(2分)
⑥随着反应的进行,浓度减小,反应速率减慢 (2分)
⑦0.11 mol·L-1;(2分)
本题解析:略
本题难度:简单