微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某学校课外活动小组在实验室中制备Fe(OH)3胶体,其制备方法是:
①将蒸馏水加热煮沸;
②在沸水中滴加______.
③煮沸至溶液刚好出现红褐色,停止加热.
回答下列问题:
(1)在步骤②中滴加的试剂是:______.
(2)该反应的化学方程式为:______.
(3)甲同学想证明Fe(OH)3胶体已制成,他可以利用______.(最简单的方法)
(4)乙同学想将Fe(OH)3胶体提纯,他可以采用的方法是______.
(5)写出Fe(OH)3胶体具备的两条性质(任写两条):①______;②______.
参考答案:(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故答案为:饱和FeCl3溶液;
(2)反应的化学方程式为FeCl3+3H2O?△?.??Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O?△?.??Fe(OH)3(胶体)+3HCl;
(3)胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,故答案为:用激光笔照射,有一条明亮的光路;
(4)溶液能透过半透膜,胶粒不能透过半透膜,利用渗析能提纯胶体,故答案为:渗析;
(5)因胶体离子直径较小,能通过滤纸,具有丁达尔效应是胶体所独有的特征性质,故答案为:丁达尔效应;能透过滤纸.
本题解析:
本题难度:一般
2、简答题 “材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请你回答以下问题:
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
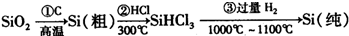
①写出步骤①的化学方程式______.
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3的主要化学操作的名称是______.
③请写出二氧化硅与氢氟酸反应的化学方程式______.
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式______.
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:______,______.
(4)纳米材料.胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是______,三氯化铁溶液可以加速伤口止血,请简述原因______.
(5)高分子材料.可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂
[AlFe(OH)nCl6-n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为______.
一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式______.
参考答案:(1)①工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,方程式为:SiO2+2C?高温?.?Si+2CO↑,故答案为:SiO2+2C?高温?.?Si+2CO↑;
②SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏,故答案为:蒸馏或分馏;
③二氧化硅只能和氢氟酸反应,方程式为:SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(2)在铁制品的电化学腐蚀中,金属铁作负极发生氧化反应,电极反应为:Fe→Fe2++2e-,故答案为:Fe→Fe2++2e-;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,故答案为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(4)胶体的分散质微粒直径范围:1nm~100nm,胶体聚沉的条件:加热、搅拌、加入电解质等,氯化铁是电解质,能使血液胶体聚沉而止血,故答案为:1nm~100nm;氯化铁是电解质,使血液胶体聚沉;
(5)化合物中铝元素显+3价,氢氧根为-1价,各元素的化合价代数和为0,故铁元素的化合价为+3价,丙烯腈(CH2=CH-CN)中的双键能发生加聚反应,方程式为:

,故答案为:+3;

.
本题解析:
本题难度:一般
3、选择题 下列应用或事实与胶体的性质没有关系的是
A.用明矾净化饮用水
B.可以利用丁达尔效应鉴别胶体和溶液
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线