微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于第三周期元素的有关叙述错误的是
A.碱性:NaOH > Mg(OH)2> Al(OH)3
B.电负性:Si< P < S
C.第一电离能:Na < Mg < Al
D.Cl-核外电子排布式:1s22s22p63s23p6
2、选择题 一种比黄金贵百倍的18O2气体,不久前在兰州近代物理研究所研究成功。1 mol这种18O2气体中含中子的物质的量为( )。
A.10 mol
B.16 mol
C.20 mol
D.36 mol
3、填空题 (18分)下表是元素周期表的一部分,回答下列有关问题:(用元素符号或化学式填空)
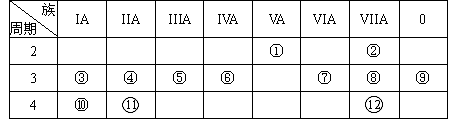
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明:答:________
在⑧与⑿中,化学性质较活泼的是________,怎样用化学实验证明?答:____________。(用化学反应方程式表示)
4、选择题 下列气态氢化物按稳定性由强到弱顺序的是(?)
A.HBr、HCl、HF
B.HF、H2O、NH3
C.NH3、PH3、H2S
D.SiH4、CH4、NH3
5、填空题 1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
H:2.1
| ?
| ?
| ?
| ?
| ?
| ?
|
Li:1.0
| Be:1.5
| B:2.0
| C:2.5
| N:3.0
| O:3.5
| F:4.0
|
Na:0.9
| Mg:1.2
| Al:1.5
| Si:1.8
| P:2.1
| S:2.5
| Cl:3.0
|
K:0.8
| Ca:1.0
| Ga:1.6
| Ge:1.8
| As:2.0
| Se:2.4
| Br:2.8
|
Rb:0.8
| Sr:1.0
| In:1.7
| Sn:1.8
| Sb:1.9
| Te:χ
| I:2.5
|
Cs:0.7
| Ba:0.9
| Tl:1.8
| Pb:1.9
| Bi:1.9
| Po:2.0
| At:2.2
|
Fr:0.7
| Ra:0.9
| ?
| ?
| ?
| ?
| ?
|
?
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解:?;?
⑵预测Te元素χ的值?;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小??;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程?。