微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1mol/L Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是
A.[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-]
B.[Na+]=2{[CO32-]+[HCO3-]+[H2CO3]}
C.[OH-]=[H+]+[HCO3-]+2[H2CO3]
D.[Na+]=[HCO3-]=[OH-]=[H+]
参考答案:D
本题解析:Na2CO3溶液发生的变化有:Na2CO3的电离、CO32-的水解。Na2CO3溶液存在如下微粒:Na+,H+;CO32-,HCO3-,OH-;H2CO3,H2O,从不同角度观察各种微粒之间定存在相互关系。Na2CO3溶液保持电中性,正电荷所带正电量等于负电荷所带负电量,存在关系[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-];Na2CO3溶液Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式;CO32-,HCO3-,H2CO3,故存在关系[Na+]=2{[CO32-]+[HCO3-]+[H2CO3]};在Na2CO3溶液中OH-都来自水的电离,水电离出[H+]=[OH-],H+在溶液中有三种存在形式:H+、HCO3-、H2CO3,故存在关系:[OH-]=[H+]+[HCO3-]+2[H2CO3]; CO32-离子水解: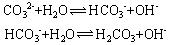 可知[HCO3-]<[OH-],因此D不正确。
可知[HCO3-]<[OH-],因此D不正确。
本题难度:简单
2、计算题 将305 g NaHCO3和Na2CO3的混合物加热至质量不再减少为止,待冷却后,称得剩余固体质量为212 g。则原混合物中Na2CO3的质量分数是多少?
参考答案:原混合物中Na2CO3的质量分数为17.4%。
本题解析:混合物中Na2CO3受热不会分解。质量减少是由于NaHCO3受热分解为Na2CO3、H2O和CO2。从NaHCO3分解反应方程式中可以看出,当168 g NaHCO3分解后,生成的Na2CO3固体的质量是106 g,两种固体质量差是62 g(即为生成的H2O和CO2总质量)。这一质量差对NaHCO3的分解反应来说是一个定值。再根据题目中所给的反应前后固体质量差(305 g-212 g)来列式计算。设混合物中NaHCO3的质量为x。
2NaHCO3 Na2CO3+H2O+CO2?固体质量差
Na2CO3+H2O+CO2?固体质量差
2×84? 168 g-106 g="62" g
x? 305 g-212 g="93" g
 ?解得:x="252" g
?解得:x="252" g
则原混合物中
w(Na2CO3)=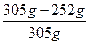 ×100%≈17.4%。
×100%≈17.4%。
本题难度:简单
3、选择题 以下关于锂、钠、钾、铷、铯的叙述不正确的是……(?)
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是铯
③它们都是热和电的良导体
④它们的密度依次增大,且都比水轻
⑤它们的还原性依次增强
⑥它们对应离子的氧化性也依次增强
A.①③
B.②⑤
C.②④⑥
D.①③⑤
参考答案:C
本题解析:从碱金属元素的原子结构入手,把握其单质及化合物的化学性质。随着核电荷数增多,碱金属原子半径增大,失电子的能力增强,其还原性增强,对应离子的氧化性减弱。根据碱金属单质物理性质变化规律,它们的熔点逐渐降低,密度逐渐增大,但钾却反常,密度小于钠。
本题难度:简单
4、选择题 钾和另一碱金属组成的混合物5.2g 与水完全反应时放出氢气2.24L(标况),则另一碱金属一定是(?)?
A.Na
B.Rb
C.Cs
D.Fr
参考答案:A
本题解析:略
本题难度:简单
5、填空题 分在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止。

(1)装置B的淡黄色粉末是____________,?干燥管C中的白色固体应为_____________,
(2)A中发生反应的离子方程式为____________,
(3)B中发生的化学反应方程式为____________。
参考答案:(1) Na2O2(或过氧化钠)(1分), 无水硫酸铜(或CuSO4) (1分)?
(2)CaCO3+2H+===Ca2++CO2↑+H2O? (2分)
(3)2Na2O2+2CO2===2Na2CO3+O2(2分)
本题解析:在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末是Na2O2,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末是CuSO4变蓝;当打开活塞(1)(2)时,气体通过B后产生O2,才使D中蜡烛火焰变得更明亮,即:2Na2O2+2CO2===2Na2CO3+O2;关闭活塞(1)时,A中反应可自行停止,说明A中是CaCO3固体,与烧杯中是盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O。
本题难度:一般