微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
?族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA
1
① |
2
②
③
④
3
⑤
⑥
⑦
⑧
|
(1)由①、③、⑧三种元素形成的离子化合物的电子式为______;由②、④两元素构成的三原子分子的极性为______.
(2)⑥的原子结构示意图为______;⑦的氧化物的晶体类型是______.
(3)②、③、⑦最高价含氧酸的酸性由弱到强的顺序是______.
(4)④、⑤、⑧三种元素可形成“84”消毒液的有效成分,写出该化合物中存在的化学键的类型为______.
参考答案:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)①、③、⑧三种元素形成的离子化合物为氯化铵,其电子式为

,②、④两元素构成的三原子分子为CO2,结构对称,正负电荷的中心重合,为非极性分子,
故答案为:

;非极性分子;
(2)Al的原子序数为13,其原子结构示意图为
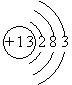
,⑦的氧化物为SiO2,是由原子以共价键结合具有网状结构的原子晶体,
故答案为:

;原子晶体;
(3)非金属性越强,最高价含氧酸的酸性越强,非金属性为N>C>Si,所以最高价含氧酸的酸性由弱到强的顺序是H2SiO3<H2CO3<HNO3,故答案为:H2SiO3<H2CO3<HNO3;
(4)④、⑤、⑧三种元素可形成“84”消毒液的有效成分为NaClO,含有离子键和极性共价键,故答案为:离子键、极性共价键.
本题解析:
本题难度:简单
2、选择题 下列说法中,正确的是( )
A.原子最外层电子数为2的元素一定是金属元素
B.HF、HCl、HBr、HI的热稳定性和还原性都依次增强
C.同主族元素形成的氧化物晶体类型相同
D.化合物XY3中,X可能呈-3价,Y可能呈+1价
参考答案:A、氦原子只有2个电子,不是金属元素,故A错误;
B、同主族自上而下,非金属性增强,所以非金属性F>Cl>Br>I,所以稳定性HF>HCl>HBr>HI,还原性HF<HCl<HBr<HI,故B错误;
C、碳元素与硅元素同族,二氧化碳是分子晶体,二氧化硅是原子晶体,故C错误;
D、化合物XY3为NH3,N呈-3价,H呈+1价,符合,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 下列元素中,属于长周期元素的是
A.Li
B.F
C.P
D.Fe
参考答案:D
本题解析:考查周期表的结构。周期表分为7个周期,前三周期属于短周期,第4、5、6周期属于长周期,第7周期属于不完全周期。所以答案选D。
本题难度:困难
4、选择题 下列说法正确的是
[? ]
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
参考答案:B
本题解析:
本题难度:一般
5、选择题 将甲、乙两种非金属的性质相比较,知道
①甲比乙容易与H2化合
②甲原子能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强
④与某金属反应时甲原子得电子数目比乙的多
⑤甲的单质熔、沸点比乙低能说明甲比乙的非金属性强的是
A.①④
B.③⑤
C.①②③
D.①②③④⑤
参考答案:C
本题解析:非金属性强弱的比较主要从以下几方面进行判断:(1)元素周期律,(2)最高价化合物对应的水化物的酸性来判断,(3)其氢化物的稳定性及化合条件,(4)与盐酸之间的置换反应或物质之间的置换反应,(5)反应的条件、剧烈程度和化合物的价态等等.C项正确.
本题难度:一般