微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.电负性最大的原子价电子构型:3S23p5
B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型
C.共价键和离子键都既有方向性又有饱和性
D.根据VSEPR理论判断SF6空间构型为 正八面体
参考答案:D
本题解析:电负性最大的原子是F,价电子构型:2S22p5?A错误
N3-、CO2和O3互为等电子体,只有CO2空间构型都是直线型,其余是V型的, B错误
根据VSEPR理论,S原子以sp3d2杂化轨道形成σ键,分子为正八面体形分子,正确。故选D。
点评:熟练掌握共价键和离子键的特点及 VSEPR理论才能准确处理各种离子,分子的空间构型。
方向性,即要按照一定的方向形成作用力。饱和性,即形成了特定数目的作用力。
离子键:阴离子与阳离子之间的作用力,离子可以看成是均匀的带电小球,所以,既没有方向性,也没有饱和性,即,只要阴离子足够大,就能在表面的各个方向尽可能多的吸引阳离子,反之,阳离子也是这样。
共价键:是原子通过电子云的重叠形成的作用,所以,既有方向性,也有饱和性,即电子云要按照一定的方向重叠,才能保证最大重叠,保证共价键的稳定性,所以导致了分子中的共价键间的键角。另外,原子都有自己特定的成键数目,如H原子只能形成1个共价键,O原子可以形成2个键,即饱和性。
本题难度:简单
2、填空题 下列是中学化学实验操作的内容:①碘的升华;②氢氧化钠溶解于水;③过氧化钠溶解于水;④氯化氢溶解于水。
其中没有发生化学键断裂的是____________;(填写序号,下同)只发生离子键断裂的是___________;只发生共价键断裂的是____________;既发生离子键断裂,又发生共价键断裂的是___________。
参考答案:①;② ;④;③
本题解析:
本题难度:一般
3、选择题 下列化学用语正确的是
[? ]
A.聚丙烯的结构简式为: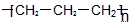
B.丙烷分子的比例模型为: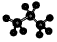
C.四氯化碳分子的电子式为:
D.2-乙基-1,3-丁二烯的键线式:
参考答案:D
本题解析:
本题难度:简单
4、简答题 现有部分短周期元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构
A
最外层电子数是次外层电子数的3倍
B
该元素是所有元素中非金属性最强的
C
L层只有5个电子
D
第3周期元素的简单离子中半径最小
|
(1)写出元素A的离子结构示意图______.写出元素C的气态氢化物的电子式______.
(2)元素B与氯元素相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______.
a.B的单质通入氯化钠水溶液不能置换出氯气
b.氯与B形成的化合物中氯元素呈正价态
c.常温下氯气的颜色比B单质的颜色深
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是______(填元素符号),理由是______.
参考答案:短周期元素,由最外层电子数是次外层电子数的3倍,则A有2个电子层,最外层电子数为6,即A为O;所有元素中非金属性最强的元素是F,则B为F;C的L层只有5个电子,则C为N;第3周期元素的简单离子中半径最小的为铝离子,则D为Al,
(1)A为O,质子数为8,得到2个电子变为离子,离子结构示意图为

,C为N,其其它氢化物为氨气,电子式为
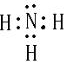
,
故答案为:

;
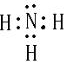
;
(2)所有元素中非金属性最强的元素是F,非金属性F>Cl,氟单质和溶液中的水反应,则不能置换出Cl,不能利用单质的颜色来比较非金属性,但在化合物中F显负价,则非金属性强,故答案为:F;b;?
(3)A、B、C、D四种元素中只有Al为金属,具有金属性,故答案为:Al;具有金属性.
本题解析:
本题难度:一般
5、填空题 多年来科学家没有间断对纯氮物种的研究和发现。第一次是 1772年分离出N2,第二次是1890年合成了重氮离子,1999年是高能氮阳离子,甚至科学家预计能合成N8。
⑴.1890年合成的重氮离子(N3-)中有一个氮氮三键,请写出其电子式_________。
⑵.经分析,1999年合成的高能氮阳离子中有5个氮原子,它们成V字形,且含有2个氮氮叁键,每个氮原子最外层均达到8电子稳定结构,试推断该离子所带的电荷数为_________,写出其电子式和结构式____________。
⑶.请你预计科学家即将合成的N8的电子式__________以及它的结构式____________;N8属于__________(填写“单质”、“共价化合物”、“离子化合物”);其含有的化学键有___________;预计它在常温下是___________体,熔沸点__________,熔融状态下__________(会、不会)导电。
参考答案:⑴ 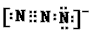
⑵ 1个单位正电荷; [N≡N→N←N≡N]+
[N≡N→N←N≡N]+
⑶ 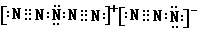 ; [N≡N→N←N≡N]+[N←N≡N]- ; 单质; 离子键、非极性共价键、配位键; 固; 较高; 会
; [N≡N→N←N≡N]+[N←N≡N]- ; 单质; 离子键、非极性共价键、配位键; 固; 较高; 会
本题解析:
本题难度:一般