微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
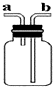
1、简答题 如图所示装置,在化学实验中十分常见,它可以作为制取气体、收集气体、性质验证、安全防护等多种作用,按要求回答相关问题:
(1)干燥CO2气体时,广口瓶中可装入的试剂1是______.
(2)除掉CO中混有的CO2,可以在广口瓶中盛装试剂2______溶液.
(3)用此装置可以用排气法收集CO2气体,应从导管口______进______出.(填a或b)
如果用此装置收集CO气体,应怎样操作,简述操作方法:______.
(4)广口瓶C中盛有BaCl2溶液,如果从b端通入CO2气体,甲同学说有沉淀生成,乙同学说没有沉淀出现.根据你所掌握的知识,判断其正确性,选择你同意的一方意见回答相关问题(两项全答计0分).
I.我同意甲同学意见,得到的沉淀物质化学式为______.
II.我同意乙同学意见,如要出现沉淀,可以预先在广口瓶中加入一些试剂3,再通入CO2气体,立即会出现沉淀,则试剂3可以是______(填试剂名称或化学式).
参考答案:(1)浓硫酸与二氧化碳不反应,浓硫酸具有吸水性,能干燥CO2气体,
故答案为:浓硫酸;
(2)若将气体通过NaOH,CO2与NaOH反应生成碳酸钠和水而被吸收,一氧化碳与氢氧化钠不反应,可除去CO中混有的少量CO2气体,从b端进,从a端出,
故答案为:NaOH;
(3)二氧化碳比空气重,用排空气法收集,应从b端进,从a端出,一氧化碳的密度比空气略小,不能用排空气法,只能用排水法,方法是将广口瓶盛满水,从a端通入气体,水从b端排出,
故答案为:b;a;将广口瓶盛满水,从a端通入气体,水从b端排出;
(4)I.如果氯化钡与二氧化碳反应,则生成碳酸钡和盐酸,因盐酸酸性比碳酸强,所以碳酸钡能溶解在盐酸中生成氯化钡和水和二氧化碳,前后矛盾,故甲同学意见错误;
II.二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠与氯化钡反应生成碳酸钡和水,碳酸钡难溶于水为白色沉淀,
故答案为:NaOH溶液;
本题解析:
本题难度:简单
2、实验题 (12分)某学业生利用以下装置制备氨气,并完成氨气的喷泉实验。

请回答下列问题:
(1)装置A中发生反应的化学方程式?。
(2)装置B中所盛的试剂是?。
(3)如果将制备氨气和氨气喷泉组合为一整套实验,用字母表示接口的连接顺序:
(?)、(?)、C、(?)(?)(?)(?)(?)
(4)组装好装置,检查装置的气密性后,加入试剂关闭K3,打开K1?、K2给A装置试管进行加热。当?(填写现象)时,即烧瓶中氨气收满。
(5)装置E的作用?。
(6)请叙述引发该喷泉实验的操作过程?。
参考答案:
(1)2NH4Cl+Ca(OH)2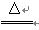 CaCl2+2NH2↑+2H2O(2分)
CaCl2+2NH2↑+2H2O(2分)
(2)碱石灰(2分)
(3)a、b、h、I、d、e、f(2分)(错一个空该项为0分)(h与I可对调)
(4)D中的酚酞溶液变红(2分)
(5)储存氨气、调节装置中的压强起到安全作用(2分)
(6)打开K3,关闭K1、K2用手握住(或用热、冷毛巾握住)圆底烧瓶,一会儿,松开手,即可引发喷泉(2分)
本题解析:略
本题难度:一般
3、选择题 某无色气体可能由 O2、 CO2、 HCl、NH3、NO 、 Br2?中的一种或几种组成 , 通过图中洗气瓶后气体体积减少 , 通过干燥管后气体呈红棕色 , 则下列推断正确的是:
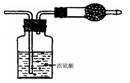
A.干燥管内固体为碱石灰
B.原气体中一定有 NO 和 O2
C.原气体中一定有NH3、NO 、CO2
D.原气体中有 HC1、 Br2
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (16分)乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途。草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上。
 KMnO4 + H2C2O4?+ (?)---K2SO4 + CO2↑+ MnSO4 + (?)
KMnO4 + H2C2O4?+ (?)---K2SO4 + CO2↑+ MnSO4 + (?)
(2)整个实验过程中不需要的仪器有?(填序号)。
a.托盘天平(带砝码,镊子)b.酸式滴定管? c.烧瓶
d.100mL容量瓶? e.烧杯? f.漏斗? g.锥形瓶
h.玻璃棒? i.药匙?
(3)实验中,标准KMnO4溶液应盛装在____式滴定管中。滴定终点时溶液的
颜色变化为?。
(4)在滴定过程中若用去amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为________mol·L-1,由此可计算x的值是___________。
(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4·2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为?
参考答案:(1)2KMnO4 +5 H2C2O4?+ 3H2SO4 ="==" K2SO4 + 10CO2↑+2 MnSO4 + 8H2O ?
(2)c , f?
(3)酸?溶液由无色变为浅紫色且半分钟不褪色?
(4)? 0.1aV?(5) C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-) > c(OH-)
本题解析:根据题目中给出的条件,可以判断硫酸是反应物,根据守恒关系,可以判断生成物还有水,根据化合价的升高降低一致可以得到
(1)2KMnO4 +5 H2C2O4?+ 3H2SO4 ="==" K2SO4 + 10CO2↑+2 MnSO4 + 8H2O
(2)称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定,整个实验过程中必须的仪器a.托盘天平(带砝码,镊子)b.酸式滴定管 d.100mL容量瓶? e.烧杯? g.锥形瓶 h.玻璃棒? i.药匙?
(3)实验中,标准KMnO4溶液应盛装在酸式滴定管中,因为酸性高锰酸钾溶液具有强氧化性,会腐蚀橡胶软管,所以只能放在酸式滴定管中。滴定终点时溶液的颜色变化为溶液由无色变为浅紫色且半分钟不褪色
(4)在滴定过程中若用去amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度根据定量关系2KMnO4? ---? -----5 H2C2O4 ?
2? 5
av/1000? 0.025y
所以y=0.1aV?
H2C2O4·xH2O 其摩尔质量是(18x+2+24+64)g/mol?
其物质的量是w/[(18x+2+24+64)] mol?实验时从100.00mL水溶液,量取25.00mL进行试验,所以滴定时消耗掉的草酸是0.01av? mol
所以0.01av=w/[(18x+2+24+64)]?所以 x=
(5)该小组同学将0.02mol草酸晶体(H2C2O4·2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,因为草酸是二元中强酸,钠离子浓度最大,其次是HC2O4-仅仅小于钠离子浓度,氢离子有两部分构成,一部分是水电离的一部分是草酸电离的,所以c(H+)>c(C2O42-),所以该溶液中各离子浓度由大到小的顺序为 C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-) > c(OH-)
点评:解答本题要从实验的目的出发,抓住定量关系,问题都会迎刃而解。酸碱中和滴定,是用已知物质量浓度的酸(或碱)来测定未知物质物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。实验中石蕊等做酸碱指示剂来判断是否完全中和。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:一般
5、填空题 (4分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
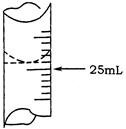
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ??;
(2)乙学生做了三组平行实验,数据记录如下:
实验序号
| 待测NaOH溶液的体积/mL
| 0.1000mol·L-1HCl溶液的体积/mL
|
滴定前刻度
| 滴定后刻度
|
1
| 25.00
| 0.00
| 26.11
|
2
| 25.00
| 1.56
| 31.30
|
3
| 25.00
| 0.22
| 26.31
|
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 ?(小数点后保留四位);
(3)下列哪些操作会使测定结果偏高?(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)? △H= ―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)? △H= ―47.2 kJ?mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)? △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
__________________________________________________。
参考答案:(1)23.80mL
(2)0.1092mol·L-1
(3)AC
(4)CO(g)+FeO(s)=Fe(s)+CO2(g) ?△H=-218.0kJ?mol-1
本题解析:(1)图中滴定管所显示的刻度为23.80mL,则消耗的体积为23.80-1.10=23.80mL。
(2)消耗的盐酸的平均体积为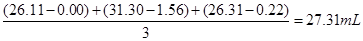
待测液的浓度为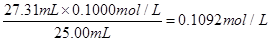
(3)锥形瓶不需要润洗;滴定前酸式滴定管尖端气泡未排除,会导致实际用量变小,从而导致最终结果偏高。
(4)CO(g)+FeO(s)=Fe(s)+CO2(g),其反应热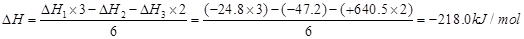
故其热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) ?△H=-218.0kJ?mol-1
点评:在解答本题时,对于中和滴定,应注意酸碱滴定管的使用,碱式滴定管不能装氧化性试剂。另外,对于热化学方程式的书写,其难点在于反应热的计算。计算反应热时,应运用盖斯定律,即将方程式式进行加减乘除,得到目标方程式,相应的反应热也进行加减乘除,即可得到目标方程式的反应热。
本题难度:一般