|
高考化学知识点整理《气体的净化、干燥、吸收与收集》高频考点巩固(2017年模拟版)(八)
2017-08-01 01:23:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)实验室用Na2SO4·10H2O配制500ml,0.100mol/L的Na2SO4溶液
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、?、?。
(2)本实验须称量硫酸钠晶体(Na2SO4·10H2O)为?g。
(3)用Na2SO4·10H2O配制标准溶液的正确顺序是?。
A.冷却
B.称量
C.洗涤
D.定容 E.溶解 F.摇匀 G.移液
| (4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒。?。
②定容时俯视容量瓶的刻度线。?。
参考答案:(1)500mL容量瓶(2分)?玻璃棒(1分)(2)? 16.1?(2分)
(3)B E A G C D F?(2分)(4)①?偏低?②?偏高?(各1分)
本题解析:略
本题难度:简单
2、选择题 如图所示的装置最适宜于干燥、收集的气体是
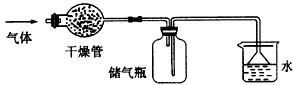
[? ]
A.NO2
B.HCl
C.CH4
D.NH3
参考答案:D
本题解析:
本题难度:简单
3、实验题 无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用或由无水氯化氢气体与熔融Al作用而制得,某课外活动小组在实验室内通过下列装置(如下图)制取少量纯净的无水氯化铝。

试回答以下问题:
(1)装置A中反应的化学方程式??
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。如果A产生的气体直接进入B中,实验产生的不良后果是?。
(3)进行实验时,应先点燃(填写字母,下同)?处的酒精灯,然后再点燃?
?处的酒精灯。
(4)在C处可以收集到纯净的氯化铝,原因是?。
(5)装置D的作用是?。
参考答案:(1)MnO2+4HCl(浓) 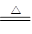 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
(2)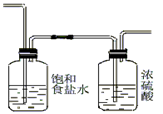 AlCl3与H2O反应而爆炸;(3)A ; B (4) AlCl3易升华 AlCl3与H2O反应而爆炸;(3)A ; B (4) AlCl3易升华
(5)吸收多余的Cl2且防止水蒸气进入C使AlCl3发生水解
本题解析:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,所以装置A中反应的化学方程式为MnO2+4HCl(浓) 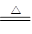 MnCl2+Cl2↑+2H2O。 MnCl2+Cl2↑+2H2O。
(2)浓盐酸具有挥发性,所以生成的氯气中含有氯化氢和水蒸气。氯化氢和铝能反应生成氢气,氢气和氯气混合会发生爆炸。另外氯化铝极易吸水,无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,所以在通过B之前需要除去氯化氢和水蒸气,使用的试剂分别是饱和食盐水和浓硫酸。
(3)由于装置中还含有空气,因此要利用氯气将空气排除,以及防止空气氧化金属铝,所以进行实验时,应先点燃A处的酒精灯,然后再点燃B处的酒精灯。
(4)由于AlCl3易升华,所以在C处可以收集到氯气。
(5)氯气有毒,污染环境,所以需要尾气处理;另一方面氯化铝极易吸水,因此碱石灰的的主要是吸收多余的Cl2且防止水蒸气进入C使AlCl3发生水解。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
4、填空题 (14分)高纯六水氯化锶(SrCl2·6H2O)可用于制造高档磁性材料、电解金属钠的助熔剂、高档颜料和液晶玻璃等,具有很高的经济价值。高纯六水氯化锶的制备过程如下:
Ⅰ.将纯水加入烧杯内,搅拌下加入适量工业碳酸锶粉末(含少量Ba、Fe的化合物),制成浆料。
Ⅱ.缓慢加入工业盐酸进行酸化,将固体物质溶解。
Ⅲ.然后喷淋加入适量的硫酸,再加入质量分数为30%的双氧水少许。
Ⅳ.调节pH至8~10, 加热至60~70℃, ,搅拌1h,过滤,除去残渣。
Ⅴ.滤液加热至沸,继续浓缩至氯化锶质量浓度(溶质质量与溶液体积之比)为 x g/L。
请回答:
(1)用电子式表示HCl的形成过程?。
(2)已知Sr为第五周期第ⅡA族元素,则不符合Sr>Ca的是?(填序号)。
①原子半径?②最外层电子数
③金属性?④最高价氧化物对应的水化物的碱性
(3)写出步骤Ⅱ中加入盐酸时发生反应的离子方程式:?。
(4)加入硫酸后会先生成硫酸锶沉淀,进而转化为硫酸钡沉淀,试分析原理?。
(5)步骤Ⅲ中在酸性环境下加入双氧水是为将亚铁离子氧化成铁离子,写出该反应的离子方程式:?。
(6)步骤Ⅳ中调节pH至8~10,最好选用的试剂为?。
(7)已知某次实验得到浓缩后的氯化锶溶液中溶质为818g,溶剂为1000 g,经测定该溶液的密度为1.5 g/mL,则该溶液溶质的质量浓度x为??g/L(计算结果保留整数)。
参考答案:(14分)
(1) (2分) (2分)
(2)②(2分)
(3)SrCO3+2H+=Sr2++H2O+CO2↑(2分)
(4)溶液中大部分是氯化锶,所以加入硫酸后会先生成硫酸锶,由于硫酸钡的溶解度小于硫酸锶,所以会进一步转化为硫酸钡沉淀(2分)
(5)2Fe2+ + H2O2 + 2H +=2Fe3+ + 2H2O (2分)
(6)Sr(OH)2(2分)
(7)675(2分)
本题解析:略
本题难度:一般
5、选择题 下列气体只能用排水集气法收集的是
A.NO
B.NO2
C.SO2
D.NH3
参考答案:A
本题解析:根据气体的性质分析,气体只能用排水集气法收集,说明该气体能够与空气中的成分发生反应,且该气体不与水反应,在水中溶解度较小,据此进行解答。A.一氧化氮能够与空气中的氧气反应生成二氧化氮,所以一氧化氮只能使用排水法收集,故A正确;B.二氧化氮密度大于空气,不与空气中的成分反应,且NO2溶于水与水反应生成NO和硝酸,因此只能使用排空气法收集,故B错误;C.二氧化硫与水反应,收集二氧化硫气体一般采用排空气法,故C错误;D.氨气极易溶于水,不能使用排水法水解氨气,氨气密度小于空气,可以使用排空气法收集,故D错误;故选A。
本题难度:一般
|