| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《化学平衡》考点特训(2017年冲刺版)(四)
 参考答案:C 本题解析: 本题难度:简单 3、选择题 在相同的温度下,已知反应:①N2(g)+O2(g) |
参考答案:B
本题解析:
试题解析:平衡常数越大,说明反应进行越彻底,题中反应①K很小,进行的程度很小;反应②K值很大,进行的程度很大,故选B。
考点:化学平衡常数
本题难度:一般
4、填空题 用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题: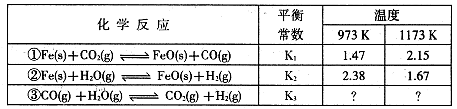
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示: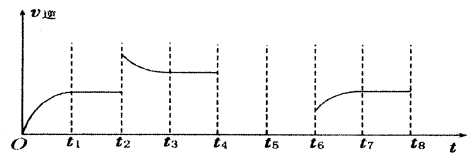
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。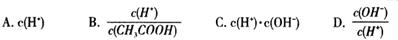
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
参考答案:Ⅰ
(1)吸热
K2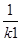
①升高温度或增大CO2的浓度(增大H2的浓度)
②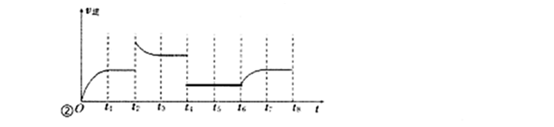
Ⅱ、(1)3
(2)BD
(3) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
本题解析:Ⅰ(1)升高温度,平衡常数增大,正反应是吸热反应。
K3=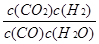 而K1=
而K1=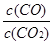 ,K2=
,K2=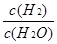 故K3=K2X
故K3=K2X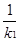
(3)?升高温度或增大CO2的浓度(增大H2的浓度)
Ⅱ、(1)根据c(H+)=c(HAc)
本题难度:困难
5、选择题 能确认发生了化学平衡移动的是 ( )
A.化学反应速率发生了变化
B.物质的浓度发生了变化
C.有气体参加的可逆反应达平衡后,对容器的压强增大
D.由于某一条件的改变,平衡混合物中各组分物质的浓度发生了不同程度的改变
参考答案:D
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《金属及其化.. | |