微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列给定条件的溶液中,一定能大量共存的离子组是
A.与Al反应放出H2的溶液:K+、Na+、Cl-、NO3-
B.c(Fe3+)=0.1mol?L-1的溶液:K+、ClO-、SO42-、SCN-
C.pH=7的溶液:Na+、Fe3+、SO42-、Cl-
D.=0.1?mol?L-1的溶液:Na+、K+、SiO32-、NO3-
参考答案:D
本题解析:分析:A.与Al反应放出H2的溶液如呈酸性,应为非氧化性酸;
B.Fe3+与反应的离子不能大量共存;
C.Fe3+水解呈酸性;
D.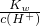 =0.1?mol?L-1的溶液呈碱性.
=0.1?mol?L-1的溶液呈碱性.
解答:A.与Al反应放出H2的溶液如呈酸性,NO3-不能大量存在,故A错误;
B.Fe3+与SCN-发生络合反应不能大量共存,故B错误;
C.Fe3+水解呈酸性,不能存在与中性溶液中,故C错误;
D.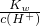 =0.1?mol?L-1的溶液中c(OH-)=0.1mol?L-1,呈碱性,在碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
=0.1?mol?L-1的溶液中c(OH-)=0.1mol?L-1,呈碱性,在碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,涉及常见离子性质的综合应用,侧重于元素化合物知识的考查,易错点为C,注意溶液铁离子水解呈酸性的性质,题目难度不大.
本题难度:一般
2、选择题 下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O
B.BF3
C.CCl4
D.PCl5
参考答案:C
本题解析:试题分析:A中H2O中H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,分子中H原子不满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,分子中O原子满足8电子结构,故A不符合;
B中BF3中B元素的化合价是+3价,最外层电子数是3个,3+3=6,不能满足8电子稳定结构;
C中四氯化碳中碳元素化合价为+4,碳原子最外层电子数为4,所以4+4=8,分子中碳原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,分子中Cl原子满足8电子结构,故C符合;
D中PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,分子中Cl原子满足8电子结构,故D不符合,答案选C。
考点:考查分子8电子结构判断
点评:本题是对共价键的理解,掌握满足8电子结构的判断规律,如果|化合价|+元素原子的最外层电子数=8,则满足最外层8电子结构,注意分子有H原子一定不满足8电子结构,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
3、选择题 下列物质中,既含有离子键,又含有共价键的是
A.H2O
B.CaCl2
C.NaOH
D.Cl2
参考答案:C
本题解析:试题分析:A中H2O分子是只含H—O共价键的共价化合物分子;B中CaCl2是离子化合物,且只含离子键;C中NaOH是含有H—O共价键的离子化合物;D中Cl2是含有非极性键的单质分子,因此正确的答案选C。
考点:本题考查离子键、共价键的成键实质、成键条件等
点评:该题是高考中的常见考点,属于基础性试题的考查,试题贴近高考,有利于考查学生分析问题、解决问题的能力。该题的关键是明确离子键、共价键的形成条件和微粒,然后结合题干信息具体问题、具体分析即可。
本题难度:困难
4、选择题 下列物质中,属于共价化合物的是
A.H2
B.HCl
C.NaCl
D.NaOH
参考答案:B
本题解析:全部由共价键形成的化合物是共价化合物,含有离子键的化合物是离子化合物,所以选项B是共价化合物,CD都是离子化合物,A是单质,答案选B。
本题难度:简单
5、选择题 下列各组物质中,按熔点由低到高排列的是
A.O2、I2、Hg
B.CO2、KCl、SiO2
C.Na、K、Rb
D.NaCl、KCl、RbCl
参考答案:B
本题解析:A:碘为固态,而汞为液态;C:碱金属均为金属晶体;D:离子晶体的熔点由离子键的强弱决定,而离子键的强弱由离子的半径决定,故答案为B,三者分别为分子晶体、离子晶体、原子晶体
本题难度:困难