微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____?硝酸(填“浓”或“稀”),相应的离子方程式是?。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)=?。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H=?。
2NO2(g)的△H=?。
③若向平衡混合物中再充入NO、NO21mol,此时v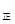 ?v
?v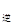 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____?(填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____?(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO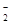 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____?。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____?。
参考答案:
(1)稀;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①0.05 mol/(L·min)?②-2Q kJ/mol?③=?④逆向;增大
(3)2Al+NO2-+OH-+2H2O=2AlO2-+NH3·H2O
本题解析:
试题解析:(1)浓硝酸还原产物为NO2,稀硝酸还原产物为NO,转移电子数相同时,稀硝酸的用量少。
(2)①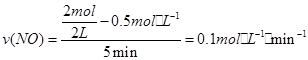 ,则v(O2)=0.05mol·L-1·min-1。
,则v(O2)=0.05mol·L-1·min-1。
②反应消耗NO:2mol-0.5mol/L×2L=1mol,放热QkJ,则消耗2molNO放热2QkJ。
③根据题中数据可知,平衡时NO、O2、NO2的物质的量浓度分别为0.5mol/L、0.25mol/L、0.5mol/L,则该温度下的平衡常数: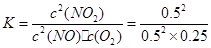 ?=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
?=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
④充入NO2则产物浓度增大,平衡逆向移动。因NO2浓度增大,因此平衡时其体积分数增大。
(3)根据加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出可知有氨水生成,则Al失电子,NO2-得电子,根据氧化还原反应电子得失守恒及电荷守恒,可写出化学方程式。
本题难度:一般
2、选择题 将4 mol A气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  ?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是:①用物质A表示的反应的平均速率为0.3 mol/(L·s);②用物质B表示的反应的平均速率为0.6 mol/(L·s);③反应达到平衡时,A、B、C的反应速率一定相等;④反应达到平衡时,A、B、C的物质的量均不再变化
?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是:①用物质A表示的反应的平均速率为0.3 mol/(L·s);②用物质B表示的反应的平均速率为0.6 mol/(L·s);③反应达到平衡时,A、B、C的反应速率一定相等;④反应达到平衡时,A、B、C的物质的量均不再变化
A.①③? B.①④? C.②③? D.③④
参考答案:B
本题解析:? 2A(g)+B(g)  ?2C(g)
?2C(g)
起始浓度(mol/L)? 2? 1? 0
转化浓度(mol/L)? 0.6? 0.3? 0.6
平衡浓度(mol/L)? 1.4? 0.7? 0.6
①用物质A表示的反应的平均速率为0.6mol/L÷2s=0.3 mol/(L·s),①正确;
②用物质B表示的反应的平均速率为0.3mol/L÷2s=0.15 mol/(L·s),②不正确;
③反应达到平衡时,正逆反应速率一定是相等的,但A、B、C的反应速率不一定相等,③;
④反应达到平衡时,A、B、C的物质的量均不再变化,④正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型,试题针对性强,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和规范答题能力。该类试题需要明确的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某时刻的量,然后依据已知条件列式计算即可。
本题难度:一般
3、选择题 经一定时间后,可逆反应aA+bB 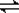 ?cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
?cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )

A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
参考答案:B
本题解析:由图可知当温度为T2时,反应达平衡状态,当温度再升高时,A的含量增多,C的含量减少,即可得该反应的正反应方向为放热反应;所以
A错,应温度为T2时达到化学平衡;B正确;C错,该反应的正反应方向为放热反应;D错,升高温度平衡向逆反应方向移动;
本题难度:简单
4、填空题 (1)(浙江高考)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(2)(天津高考)写出WO3(s)+3H2(g) W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。
(3)(福建高考)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:________。
?
参考答案:(1)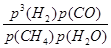 增大
增大
(2)K=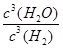
(3)平衡常数随温度升高而变小
本题解析:(1)据题中Kp的描述可知,Kp=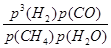 。该反应为吸热反应,温度升高,平衡正向移动,Kp增大。
。该反应为吸热反应,温度升高,平衡正向移动,Kp增大。
(2)根据反应的化学方程式可知,该反应的平衡常数表达式为K=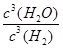 。(3)该反应的正反应是一个气体分子数减小的反应,反应达到平衡状态,体系压强升高,说明正反应是一个放热反应,升高温度,平衡向左移动,即化学平衡常数随温度升高而减小。
。(3)该反应的正反应是一个气体分子数减小的反应,反应达到平衡状态,体系压强升高,说明正反应是一个放热反应,升高温度,平衡向左移动,即化学平衡常数随温度升高而减小。
本题难度:一般
5、选择题 在密闭容器中发生反应:aX(g)+bY(g)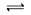 cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动
B.a + b > c + d
C.Z的体积分数减小
D.X的转化率下降
参考答案:B
本题解析:保持温度不变,将气体压缩到原来的1/2体积的瞬间,W的浓度为原平衡的2倍。但当再次达到平衡时,W的浓度为原平衡的1.8倍,这说明增大压强,平衡向逆反应方向移动,即正方应是体积增大的可逆反应,选项ACD正确,B不正确,所以正确的答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对学生基础知识检验和训练的同时,侧重对学生能力的培养。该题的关键是明确浓度瞬间的变化量和最终浓度变化量的关系,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般