微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 下表为元素周期表的一部分,请回答有关问题
?
| IA
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ?
| ③
| ④
| ⑤
| ?
| ⑥
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
(1)⑤和⑧的元素符号是______和_______;
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式:__________________________________。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_________________________。
参考答案:(1)Si? Ar(2)K? F
(3)Al?Al(OH)3+KOH=KAlO2+2H2O
(4)在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强。
本题解析:(1)①到⑩分别为N、F、Mg、Al、Si、S、Cl、Ar、K、Br,所以⑤和⑧的元素符号是Si? Ar,(2)表中最活泼的金属是K,非金属性最强的元素是F,(3)表中能形成两性氢氧化物的元素是Al ,⑨的最高价氧化物对应水化物为KOH,所以铝与其反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O,(4)要比较Cl与Br的氧化性强弱,可以在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强。
点评:本题考查了元素周期表,是对基础知识的考查,是高考考查的重点,本题难度不大。
本题难度:一般
2、选择题 下列微粒中:①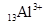 ?②
?②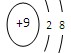 ?③
?③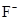 ,④
,④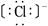 其核外电子数相同的是( )
其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
参考答案:A
本题解析:①②③④四种微粒核外电子数分别是10、10、10、18,选A。
本题难度:简单
3、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,W单质的熔、沸点最高
D.W的单质能与水反应,生成一种具有漂白性的物质
参考答案:D
本题解析:Y原子的最外层电子数是内层电子数的3倍,核外各层电子数为2、6,应为O元素,根据四种元素在周期表中的位置可知,X为N元素,Z为S元素,W为Cl元素,
A、同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,故A错误;
B、同周期元素从左到右元素的非金属性逐渐增强,根据元素的非金属性越强,对应最高价氧化物的水化物的酸性越强可知最高价氧化物对应水化物的酸性:W>Z,故B错误;
C、四种元素的单质中,常温下Z的单质是固体,其余均是气体,Z单质硫的熔、沸点最高,故C错误;
D、氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,故D正确.
故选D。
点评:本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意把握元素周期律的递变规律。
本题难度:简单
4、填空题 A、B、C、D、E五种元素在周期表里的位置如下表所示:
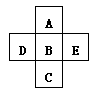
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。
C元素名称是 ,D的最高价氧化物对应水化物的化学式 ,实验室制取单质E的化学方程式 ?。
参考答案:硒?磷酸? MnO2+4HCl(浓)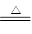 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
本题解析:根据周期表的结构可知,五种元素位于周期表的右侧,分别是第二、第三和第四周期。E为该周期中原子半径最小的元素,所以E是Cl,则B是S,D是P,A是O,C是Se。实验式制取氯气的化学方程式为MnO2+4HCl(浓)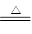 MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
本题难度:简单
5、填空题 近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。

请回答下列问题:
(1)镉元素的原子序数为?,在元素周期表中的位置是?。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论??。
(3)你认为“毒大米”中镉的来源是什么??。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O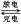 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是?。
负极的电极反应式为?。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA=?。
参考答案:(9分)?(1)48(1分)?第五周期第ⅡB族(1分)
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害。(1分)
(3)工业生产造成了土壤的镉污染,富集在大米中(1分)
(4)Cd(镉)(1分)? Cd-2e—+2OH—=Cd(OH)2(2分)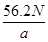 mol—1(2分)
mol—1(2分)
本题解析:(1)镉元素在元素周期表中的图示可知,镉元素的原子序数为48,在元素周期表中的位置是第五周期第ⅡB族。
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害,所以这种说法是错误的。
(3)“毒大米”中镉的来源是工业生产造成了土壤的镉污染,富集在大米中。
(4)放电相当于是原电池,原电池中负极失去电子,化合价升高,发生氧化反应。所以根据化学方程式可知,该电池的负极是Cd,负极电极反应式是Cd-2e—+2OH—=Cd(OH)2。agCd的物质的量是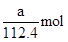 ,在反应中失去
,在反应中失去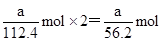 电子,所以阿伏加德罗常数NA=
电子,所以阿伏加德罗常数NA=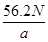 mol—1。
mol—1。
点评:该题以近期曝出的“毒大米”事件为载体,重点考查学生对元素周期表结构、原电池原理以及灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。也有助于培养学生的环境保护意识,增强学生的社会责任感。
本题难度:一般