微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设阿伏加德罗常数为6.02×1023mol-1.下列关于1molH2O的叙述正确的是( )
A.含有1molH2
B.在标准状况下体积为22.4L
C.含有6.02×1023个水分子
D.质量为18g/mol
参考答案:A.水是由氢、氧两种元素组成,不存在氢气,故A错误;
B.标况下,水是液态,不能使用气体摩尔体积计算其体积,1mol水的体积小于22.4L,故B错误;
C.1molH2O含有水分子数目=1mol×=6.02×1023mol-1=6.02×1023,故C正确;
D.水的摩尔质量为18g/mol,1mol水的质量为18g,故D错误,
故选C.
本题解析:
本题难度:简单
2、选择题 配制物质的量浓度的溶液,造成浓度偏高的操作是( )
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列溶液中物质的量浓度为1mol/L的是?(?)
A.将40gNaOH固体溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L10 mol/L的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液
参考答案:D
本题解析:A、应该配成1L的溶液;
B、不是标况下,22.4L不一定为1mol;
C、最后溶液体积,不一定为10L
本题难度:简单
4、选择题 同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是
[? ?]
A. A2B
B. AB2
C. A3B
D. B3A
参考答案:C
本题解析:
本题难度:简单
5、填空题 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀A,向滤液中加入10mol/L的KOH溶液,产生沉淀的质量和加入的KOH溶液的体积(mL)如右图所示。试回答下列问题:
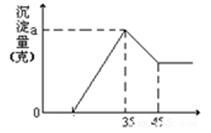
(1)沉淀A是 (填化学式),当加入KOH溶液的体积超过35mL时所发生的反应的离子方程式为 (4分)
(2)铝土矿中Al2O3的物质的量是多少?(2分)
(3)稀硫酸溶液的物质的量浓度为多少?(忽略溶液体积的变化)(2分)
参考答案:(1)SiO2 ; Al(OH)3+OH-=2H2O+AlO2- (2)n(Al2O3)=0.05mol (3)1.75mol/L
本题解析:(1)Al2O3、Fe2O3、SiO2几种物质中SiO2 不和H2SO4溶液反应,故沉淀A是SiO2 ,加入35mL氢氧化钠溶液时,沉淀量最大,此时沉淀为Al(OH)3 ,Fe(OH)3,当KOH溶液的体积超过35mL时Al(OH)3会发生溶解,离子方程式为:Al(OH)3+OH-=2H2O+AlO2- (2)从35mL~45mL段Al(OH)3会发生溶解,该段消耗的n(KOH)=0.01L×10mol/L=0.1mol,根据离子方程式Al(OH)3+OH-=2H2O+AlO2- 可知,氢氧化铝的物质的量为0.1mol则n(Al2O3)=0.05mol,(3)当加入KOH溶液的体积为35mL时沉淀量最大,此时溶液中溶质为K2SO4,根据K元素守恒有n(K2SO4)=1/2 n(KOH)=0.5×0.035L×10mol/L =0.175mol,K2SO4中的SO42-都来自于稀H2SO4,则n(H2SO4)= n(K2SO4)=0.175mol,稀H2SO4的浓度为:c(H2SO4)=n/V= 0.175mol,÷0.1L=1.75mol/L
考点:化学图像的认识、离子方程式的书写、有关物质的量的计算。
本题难度:一般