|
高考化学知识点总结《物质的量》试题预测(2017年最新版)(八)
2017-08-01 01:34:06
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某Li+原子核中含有4个中子。含6.02×1023个电子的该离子质量是( )
A.4/7 g
B.4.7g
C.3.5g
D.7/4g
|
参考答案:C
本题解析:Li+原子核中含有4个中子,则质量数是3+4=7。含6.02×1023个电子的该离子的物质的量是0.5mol,所以质量是3.5g,答案选C。
本题难度:一般
2、简答题 实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
(1)实验中除了烧杯、量筒、玻璃棒外还需要的其它仪器有:______.
(2)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸体积为______mL.(计算结果保留一位小数)
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.量取浓硫酸的量筒内有少量水;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中;
C.住容量瓶转移时,有少量液体溅出
D.将量筒洗涤后洗涤液一并转入容量瓶
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度可能造成偏大的有______(填写字母);无影响有______.
参考答案:(1)配制500ml1.0mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以需要的仪器为:烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管.
所以还需要的仪器是:500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(2)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为1000×1.84×98%98mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×1.0mol/L,解得:x≈27.2,故答案为:27.2;
(3)A.量取浓硫酸的量筒内有少量水,量取浓硫酸的体积偏小,所配溶液浓度偏小;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中进行定容,溶液冷却后导致所配溶液的体积偏小,溶液浓度偏大;
C.住容量瓶转移时,有少量液体溅出,移入容量瓶内的硫酸减少,所配溶液浓度偏小;
D.量筒为流量式仪器,将量筒洗涤后洗涤液一并转入容量瓶,移入容量瓶内硫酸增大,所配溶液浓度偏大;
E.定容时仰视刻度线,导致所配溶液的体积偏大,溶液浓度偏小;
F.溶液配制需加水定容,容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,所配溶液的体积偏大,溶液浓度偏小.
对配制的溶液物质的量浓度可能造成偏大的有BD;无影响有F.
故答案为:BD;F.
本题解析:
本题难度:一般
3、选择题 实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为? ( )。
A.950 mL;201.4 g
B.1 000 mL;212.0 g
C.100 mL;21.2 g
D.500 mL;100.7 g
参考答案:B
本题解析:实验室中没有950 mL容量瓶,故只能配制1 000 mL 2.0 mol·L-1的Na2CO3溶液。
本题难度:一般
4、选择题 用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出
B.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度
C.容量瓶使用前未干燥
D.定容时俯视容量瓶刻度线
参考答案:D
本题解析:根据c=n/V可知,在烧杯中溶解时,有少量液体溅出,则溶质的物质的量减少,浓度偏小;定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度,则溶液的体积偏大,浓度偏小;容量瓶使用前未干燥,不会影响实验结果;定容时俯视容量瓶刻度线,则容量瓶中溶液的体积偏小,浓度偏高,所以正确的答案选D。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数。如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(?)
A.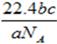
B.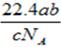
C.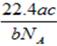
D.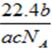
参考答案:A
本题解析:根据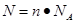 可知,ag气体的物质的量是 可知,ag气体的物质的量是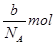 ,所以该气体的相对分子质量是 ,所以该气体的相对分子质量是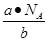 ,所以c g该气体的物质的量是 ,所以c g该气体的物质的量是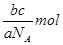 ,则在标准状况下的体积是 ,则在标准状况下的体积是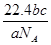 ,答案选A。 ,答案选A。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式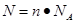 、n=m/M、 、n=m/M、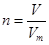 、 、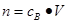 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般
|