反应的化学方程式
(1)Cl2(HCl)
?
?
╱
(2)NaCl固体(NaI)
?
?
?
(3)NaNO3溶液(NaCl)
?
?
?
参考答案:(1)氯气中的杂质氯化氢能溶于饱和食盐水中,而氯气不能溶于食盐水中,将混合气体通入饱和食盐水中,可以采用洗气的方法来分离;
(2)碘化钠可以和氯气反应生成碘单质和氯化钠,即Cl2+2I-=I2+2Cl-,碘单质受热能升华,可以将混合物溶于水,再加入氯水,最后在蒸发结晶的方法来分离;
(3)氯化钠可以和硝酸银反应生成氯化银沉淀和硝酸钠,NaNO3溶液中混有的氯化钠可以采用加入硝酸银的方法来除去,发生的反应为:Ag++Cl-=AgCl↓.
故答案为:含杂质的物质除杂试剂分离方法反应的化学方程式(1)Cl2(HCl)饱和食盐水?洗气?╱(2)NaCl固体(NaI)氯水?蒸发结晶?Cl2+2I-=I2+2Cl-?(3)NaNO3溶液(NaCl)AgNO3溶液?过滤?Ag++Cl-=AgCl↓?.
本题解析:
本题难度:一般
3、选择题 下列对物质或微粒的检验试剂和相应的现象描述不当的是( ?)
A.检验碳酸钾和碳酸钠混合溶液中的钾元素,用铂丝蘸取溶液,放在酒精灯外焰上灼烧,可看到火焰呈紫色
B.检验溶液中的Fe3+,可取少量待测液,向其中加KSCN溶液,可看到溶液呈红色
C.检验NH4+,可向溶液中加入生石灰,将湿润的红色石蕊试纸放在管口,可看到试纸变蓝
D.检验溶液中的Fe2+,可向溶液中加入KSCN溶液,此时溶液颜色无变化,之后向其中加入少量氯水,溶液变为红色
参考答案:A
本题解析:在做焰色反应时,铂丝必须事先用稀盐酸清洗,并且钾元素的焰色反应必须透过蓝色的钴玻璃才能看见紫色,A错误;Fe3+遇KSCN溶液显紫色,B正确;生石灰与水反应放热并且生成氢氧化钙,NH4+与氢氧化钙反应加热时会产生氨气,氨气与水呈碱性可以使红色石蕊试液变蓝,C正确;检验Fe2+,可向溶液中加入KSCN溶液无变化说明溶液中不含有三价铁离子,加入氯水,氯水具有强氧化性,可以氧化亚铁离子变为三价铁离子,从而使溶液变为红色证明含有亚铁离子,D正确。所以答案选A。
本题难度:一般
4、选择题 下列说法正确的是
A.某溶液中滴入AgNO3溶液,生成白色沉淀,该溶液中可能含Cl-
B.实验已经证明,氯水是可以导电的,所以氯水是电解质
C.某溶液与淀粉碘化钾溶液反应后出现蓝色,则证明该溶液是氯水
D.氟气跟氯化钠水溶液反应,有HF和O2生成
参考答案:AD
本题解析:A:正确
B:氯水是混合物,不可能属于电解质
C:只要能将I—氧化为碘,则就可出现蓝色现象,例如铁盐、硝酸溶液等
D:氟气与水发生了置换反应:2F2+2H2O=4HF+O2,正确
答案为AD
本题难度:一般
5、实验题 实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。
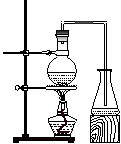 ? ?
(甲)?(乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
?
| 乙酸
| 1-丁醇
| 乙酸丁酯
| 熔点(℃)
| 16.6
| -89.5
| -73.5
| 沸点(℃)
| 117.9
| 117
| 126.3
| 密度(g/cm3)
| 1.05
| 0.81
| 0.88
| 水溶性
| 互溶
| 可溶
(9g/100g水)
| 微溶
|
?
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①?;②?
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。
 ? ?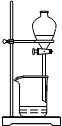  ? ? ? ?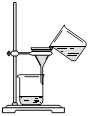
A? B? C? D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有?。
参考答案:(1)乙。由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发。
(2)CH 3CH2CH2CH2OCH2CH2CH2CH3 ?CH3CH2CH=CH2。
(3)①增加乙酸浓度?②减小生成物浓度(或移走生成物)。
(4)AB。
(5)检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)。
本题解析:(1)应该选择乙。由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发。
(2)在浓硫酸加热条件下会生成副产物醚和发生消去反应,故为CH3CH2CH2CH2OCH2CH2CH2CH3 ?和CH3CH2CH=CH2。
(3)从化学平衡移动的角度分析可知①增加乙酸浓度?②减小生成物浓度(或移走生成物)可以使平衡右移,有利于酯的生成;
(4)前者主要是萃取选A后者是分液选择B。
(5)检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)。
本题难度:一般
|