微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾(?FeSO4?7H2O?).
(1)若用98%?1.84g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:______.
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00g铁粉充分反应,收集到224mL(标准状况)气体,剩余固体质量为3.88g,测得反应后的溶液中Fe2+的物质的量为0.14mol(不含Fe3+).则该样品中Fe2+离子的氧化率为______.
(3)硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.现取0.4g?Cu2S和CuS的混合物在酸性溶液中用40mL?0.150mol/L?KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V?mL?0.2mol/L?(NH4)2Fe(SO4)2溶液完全反应.已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)①V的取值范围为______;②若V=35,试计算混合物中CuS的质量分数.
参考答案:(1)设浓硫酸的体积为xmL,水的体积为ymL;稀释前后硫酸的质量不变,
所以1.84x×98%1.84x+1.0y×100%=28%,解得x:y=1:4.6,故答案为:4.6;
(2)设与酸反应生成氢气需要的铁的质量为x,生成的硫酸亚铁的物质的量为y,
? Fe+2H+=Fe 2++H2 ↑
? ?56g?1mol?22.4L
? x?y?0.224L
解得x=0.56g,y=0.01mol,
与Fe3+反应需要的铁的质量为5.00g-3.88g-0.56g=0.56g,
与铁反应需要的三价铁离子的物质的量为m,生成的二价铁离子的物质的量为n,
Fe+2Fe3+=3Fe2+
56g?2mol?3mol
0.56g m?n
解得m=0.02mol,n=0.03mol,
所以原来溶液中二价铁离子的物质的量为0.14mol-0.01mol-0.03mol=0.1mol,
所以氧化率为0.02mol0.1mol+0.02mol=16.7%,
?故答案为:16.7%;
(3)①高锰酸钾的物质的量为:0.040L×0.150mol/L=0.006mol,
假设固体混合物全部为Cu2S,需要高锰酸钾的物质的量为x,
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
8? 5
x? 0.4g160g
x=0.004mol
剩余的高锰酸钾的物质的量为0.006mol-0.004mol=0.002mol,
0.002mol高锰酸钾和(NH4)2Fe(SO4)2溶液完全反应.
?MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol?5mol
0.002mol?1×10-3VL×0.2mol/L
解得V=50,
假设固体混合物全部为CuS,需要高锰酸钾的物质的量为y,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
6? 5
y?0.4g96g
y=0.005mol
剩余的高锰酸钾的物质的量为0.006mol-0.005mol=0.001mol.
0.001mol高锰酸钾和(NH4)2Fe(SO4)2溶液完全反应.
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol? 5mol
0.001mol? 1×10-3VL×0.2mol/L
解得V=25,
故答案为:25<V<50;?
?②若V=35,与35mL(NH4)2Fe(SO4)2溶液完全反应需要高锰酸钾的物质的量为:
? MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
? 1mol? 5mol
0.014mol?0.035L×0.2mol/L
所以高锰酸钾的物质的量为0.0014mol,
故与固体混合物反应的高锰酸钾的物质的量为0.006mol-0.0014mol=0.0046mol,
设Cu2S的质量为xg,CuS的质量为yg,x+y=0.40g.
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
8mol? 800g
0.01xmol?xg
?6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
?6mol?480g
0.0125ymol?yg
本题解析:
本题难度:一般
2、实验题 高纯MnCO3是制备高性能磁性材料的主要原料。研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制得硫酸锰晶体,再以MnSO4为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中加入一定MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2?+?H2SO3=?MnSO4?+?H2O)
①MnO2和水,搅拌,通入SO2的化学方程式为_________________________
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可用_____________
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是_______________________

(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①__________________
?②过滤,用少量水洗涤2~3次;
③是否被洗涤除去?检验SO42-
④________________?
⑤低于100℃干燥
(3)向物质的量浓度均为0.01?mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是___________(填离子符号);当两种沉淀共存时,溶液中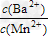 =__________。(已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11)
=__________。(已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11)
参考答案:(1)①SO2+MnO2=MnSO4;②控制适当的温度、缓慢通入混合气体;③Mn2+催化与O2 与H2SO3反应生成H2SO4
(2)①边搅拌边加入NaHCO3(或Na2CO3),并控制溶液pH < 7.7;④用少量C2H5OH洗涤?(凡合理答案均可)
(3)Mn2+ ;450
本题解析:
本题难度:一般
3、实验题 对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
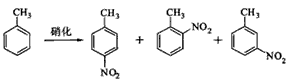
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在溶剂中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是__________。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于__________层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有__________。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
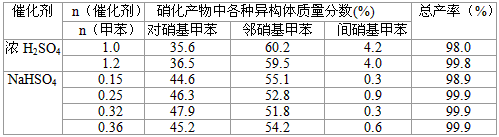
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为_____________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是______________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有____________、___________。
参考答案:(1)回收NaHSO4
(2)下;分液漏斗上口塞子未打开
(3)①0.32;②甲苯硝化主要得到对硝基甲苯和邻硝基甲苯;③在硝化产物中对硝基甲苯比例提高、
催化剂用量少且能循环使用
本题解析:
本题难度:困难
4、填空题 过氧化钙(CaO2)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2。其制备过程如下:
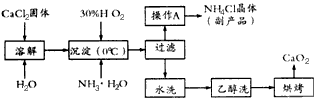
根据以上信息,回答下列问题:
(1)写出制取CaO2·8H2O的化学方程式是_________________________________。
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是_____________________________。
(3)操作A的步骤为__________________________________________。
(4)检验“水洗”已经洗净的方法是___________________________________。
(5)测定含杂质的产品中CaO2含量的实验步骤是:
(已知:①CaO2在酸性条件下将I-氧化为I2②I2+2S2O32-=2I-+S4O62-③杂质不与I-反应)
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2 mol/L的盐酸,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为________________________________。
②产品中CaO2的质量分数为____________________。 (用字母表示)
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数偏高(测定过程中由操作产生的误差忽略不计),可能的原因是___________________。
参考答案:(1)CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
(2)冰水浴冷却(或将反应容器浸泡在冰水中)
(3)向滤液中加入适量HCl,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
(4)取少许洗涤液,向其中加入稀硝酸酸化的硝酸银溶液,若不产生白色沉淀,则说明已经洗净
(5)①溶液由蓝色变为无色,并在半分钟内不再变化②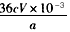 ③在酸性备件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
③在酸性备件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
本题解析:
本题难度:一般
5、实验题 如图在试管甲中先加入2mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
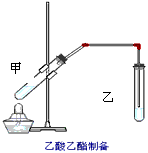
试回答
(1)试管乙中观察到的现象是___________________
(2)液体混合加热时液体容积不能超过其容积的___________,本实验反应开始时用小火加热的原因是
___________________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(3)试管甲中加入浓硫酸的主要作用是___________________;
(4)试管乙中饱和Na2CO3的作用是__________________________;
(5)写出试管甲中发生反应的化学方程式___________________;
参考答案:(1)溶液分为两层
(2)1/3;使液体受热均匀,减少乙酸和乙醇的挥发
(3)催化剂、吸水剂
(4)溶解乙醇,与乙酸反应,减小乙酸乙酯的溶解度
(5)CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
本题解析:
本题难度:一般