微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
[? ]
A.凡有单质参加的化合反应都是氧化还原反应
B.所有的复分解反应都是非氧化还原反应
C.盐酸在参加的反应中只能作氧化剂
D.金属在参加的反应中只能作还原剂
参考答案:C
本题解析:
本题难度:简单
2、选择题 在2KMnO4 +16HCl === 2KCl +2MnCl2 + 5Cl2↑+8 反应中
反应中
[? ]
A.氧化剂与还原剂物质的量之比为1∶8
B. 处对应的物质为H2O
处对应的物质为H2O
C.Cl2是还原产物
D.若1mol KMnO4参加反应,转移的电子的物质的量是7mol
参考答案:B
本题解析:解析:
该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,
A.KMnO4是氧化剂、部分HCl是还原剂,作还原剂的HCl的物质的量占HCl的10:16=5:8,氧化剂和还原剂的物质的量之比是1:5,故A错误;
B.根据原子守恒知, 处对应的物质为H2O,故B正确;
处对应的物质为H2O,故B正确;
C.Cl元素的化合价升高,失去电子被氧化,则氯气是氧化产物,故C错误;
D.若1mol?KMnO4参加反应,转移的电子的物质的量=1mol×(7-2)=5mol,故D错误;
故选:B.
本题难度:简单
3、选择题 2010年10月1日下午18时59分57秒,中国探月工程先导星“嫦娥二号”在西昌点火升空,准确入轨。月球上有着非常丰富的钛铁矿(主要成分是FeTiO3)资源。已知钛铁矿与氢气在1 000 ℃条件下发生如下反应:FeTiO3+H2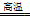 Fe+TiO2+H2O,下列有关该反应的说法错误的是( )
Fe+TiO2+H2O,下列有关该反应的说法错误的是( )
A.FeTiO3中Fe显+2价,Ti显+4价
B.TiO2既不是氧化产物也不是还原产物
C.反应中生成1 mol铁将转移3 mol电子
D.FeTiO3在反应中作氧化剂
参考答案:C
本题解析:
试卷分析:根据反应FeTiO3+H2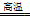 Fe+TiO2+H2O可知,FeTiO3中的Fe为+2价Ti显+4价,反应前后Ti的化合价没有变化,所以TiO2既不是氧化产物也不是还原产物。反应中Fe的化合价由+2价变为0价,生成1 mol铁将转移2mol电子且FeTiO3在反应中作氧化剂。答案选C。
Fe+TiO2+H2O可知,FeTiO3中的Fe为+2价Ti显+4价,反应前后Ti的化合价没有变化,所以TiO2既不是氧化产物也不是还原产物。反应中Fe的化合价由+2价变为0价,生成1 mol铁将转移2mol电子且FeTiO3在反应中作氧化剂。答案选C。
点评:本题主要考查的是氧化还原反应的基本概念,难度小,基础性强。
本题难度:一般
4、填空题 (1)“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为;KCN+H2O2+H2O=A+NH3↑
回答下列问题:
①生成物A的化学式为____________。
②在标准状况下若有0.448L氨气生成,则转移的电子数为____________。
③反应中被氧化的元素为____________。
(2)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直 至过量。经测定,加入的NaOH的物质的量和所得沉淀的物质的量的关系如下图所示。则:
至过量。经测定,加入的NaOH的物质的量和所得沉淀的物质的量的关系如下图所示。则:

①原溶液 中c(Mg2+)∶c(Al3+)为?。
中c(Mg2+)∶c(Al3+)为?。
②图中C点表示当加入?mol NaOH时,
Al3+已经转化为 ? ? ,
Mg2+已经转化为?。
③图中线段OA∶AB=?。
参考答案:(1)①KHCO3 ?②2.408×1022?③KCN中的C(碳)
(2)①2∶1
 ?② 0.8? NaAlO2?Mg(OH)2
?② 0.8? NaAlO2?Mg(OH)2
③7∶1
本题解析:略
本题难度:简单
5、填空题 下列两个反应均为在溶液中进行的反应,试按下列要求作答:
①在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物。
②将其改写成离子方程式;
(1) 2FeCl3 + H2S =2FeCl2 + S↓ + 2HCl
离子方程式为:____________________________________。
(2)MnO2? + 4HCl(浓)  ?MnCl2 + 2H2O? + Cl2↑
?MnCl2 + 2H2O? + Cl2↑
离子方程式为:___________________________________。
参考答案:(12分,离子方程式2分,其余每空1分)
(1)FeCl3;H2S ;S ;FeCl2;2Fe3++ H2S= 2Fe2++ S↓ + 2H+
(2)MnO2;HCl ;Cl2;MnCl2;MnO2 + 4H++2Cl- ?Mn2+ + 2H2O? + Cl2↑
?Mn2+ + 2H2O? + Cl2↑
本题解析:(1)根据反应的化学方程式可知,氯化铁中铁元素的化合价从+3价降低到+2价,得到1个电子,氯化铁是氧化剂,氯化亚铁是还原产物;H2S中S元素的化合价从-2价升高到0价,失去2个电子,H2S是还原剂,单质S是氧化产物,该题反应的离子方程式是2Fe3++ H2S= 2Fe2++ S↓ + 2H+。
(2)二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂,氯化锰是还原产物;氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂,氯气是氧化产物,该反应的离子方程式是MnO2 + 4H++2Cl- ?Mn2+ + 2H2O? + Cl2↑。
?Mn2+ + 2H2O? + Cl2↑。
点评:该题是中等难度的试题,试题基础性强,注重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑思维能力,提高学生分析问题、解决问题的能力。该题的关键字准确标出有关元素的化合价变化情况,然后依据有关的概念灵活运用即可。
本题难度:简单