微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下:
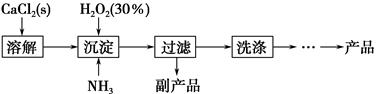
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
滴定次数
| 样品的质量/g
| KMnO4溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 0.300 0
| 1.02
| 24.04
|
2
| 0.300 0
| 2.00
| 25.03
|
3
| 0.300 0
| 0.20
| 23.24
|
?
参考答案:Ⅰ.(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl (2)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解) ②通入过量NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或使溶液呈碱性,减少CaO2·8H2O的溶解,或提高产品的产率)
Ⅱ.(3)当滴入最后一滴KMnO4标准溶液后溶液由无色变为浅紫红色,且30 s不褪色
(4)根据反应方程式2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O和CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl,构建比例式:
5(CaO2·8H2O)~5H2O2~2KMnO4
n(CaO2·8H2O)=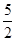 n(KMnO4)=
n(KMnO4)=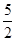 ×0.020 0 mol·L-1×23.03 mL×10-3 L·mL-1=1.151 5×10-3 mol
×0.020 0 mol·L-1×23.03 mL×10-3 L·mL-1=1.151 5×10-3 mol
CaO2·8H2O的质量分数=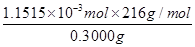 ×100%=82.91%。
×100%=82.91%。
本题解析:(1)根据流程图中的箭头指向,确定反应物有CaCl2、H2O2、NH3,产物有CaO2·8H2O,利用反应前后元素守恒,确定另一反应为H2O、副产物为NH4Cl,故反应的化学方程式为CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。(2)30%H2O2受热易分解,因此沉淀时常用冰水控制温度在10 ℃以下减少过氧化氢的分解,提高过氧化氢的利用率,由于通入NH3的步骤为“沉淀”,所以通入过量NH3使溶液呈碱性,抑制CaO2·8H2O的溶解,促使其沉淀。(3)由于用0.020 0 mol·L-1 KMnO4标准溶液(紫色)进行滴定,所以滴定终点观察到的现象为当滴入最后一滴KMnO4标准溶液后溶液由无色变为浅紫红色,且30 s内不褪色。
本题难度:困难
2、选择题 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图1所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是(?)

A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能为氯水
D.M、N必定各为BaCl2、FeSO4中的一种
参考答案:A
本题解析:能和4种物质发生反应的是Y为K2CO3;能和3种物质发生反应的是BaCl2和FeSO4,;能和2种物质发生反应的H2SO4和氯水,再综合考虑推出可能:
(1)Y:K2CO3?M:BaCl2? N:FeSO4, X:H2SO4 ?Z:氯水
(2)Y:K2CO3 ?N:BaCl2? M:FeSO4, Z:H2SO4?X:氯水
本题难度:简单
3、实验题 (10分) 二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂,常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高、二氧化氯的水溶液质量分数高于30%等均有可能引起爆炸。某研究小组设计下图所示实验装置制备ClO2。

现称取12.25gKClO3和9g草酸(H2C2O4)放入烧瓶中,然后再加入足量的稀硫酸,水浴加热。
回答下列问题:
(1)已知反应后的产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为?。
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃~
80℃之间。这样操作的目的是?,
图示装置中缺少的一种必须的玻璃仪器是?。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放?(填序号)。
a. 50mL 60℃的温水? b. 50mL冰水? c. 50mL饱和食盐水? d. 50mL NaOH溶液
(4)本实验所制得的二氧化氯水溶液质量分数约为?。(小数点后保留两位)
(5)二氧化氯可迅速氧化硫化物,以除去有机硫产生的臭味,改善水产养殖水体的水质。取适量二氧化氯溶液加入到硫化氢溶液中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。硫化氢溶液与二氧化氯发生反应的离子方程式为?。
参考答案:(1)2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O(2分)
(2)使反应正常进行,控制温度,防止温度过高引起爆炸(1分);温度计(1分)
(3)b(2分)
(4)11.89%(2分)
(5)5H2S+8ClO2+4H2O=5SO2-4+8Cl-+18H+(2分)
本题解析:略
本题难度:一般
4、实验题 (14分)实验室用固体烧碱配制500mL 1 mol/L的NaOH溶液
(1)(4分)需称量?g的烧碱固体,固体应放在?中称量。
(2)(4分)配制过程中除了烧杯还需要哪些仪器?
?
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低或无影响)(4分)
①定容时俯视刻度线??②容量瓶未干燥?
③转移过程中有少量液体溅出?
④未洗涤烧杯和玻璃棒?
(4)(2分)若定容时液面高于刻度线应采取的措施是?
参考答案:(1)(每空2分)20.0g?小烧杯
(2)(每个1分)托盘天平?玻璃棒? 500ml容量瓶?胶头滴管
(3)(每个1分)偏高?无影响?偏低?偏低
(4)2分?重新配制
本题解析:考查一定物质的量浓度的配制。
(1)根据物质的量浓度的概念可知,需要氢氧化钠的物质的量为0.5L×1mol/L=0.5mol,其质量是0.5mol×40g/mol=20.0g.氢氧化钠易潮解,称量时要放在小烧杯中称量。
(2)称量需要托盘天平,溶解需要玻璃棒,定容需要500ml容量瓶和胶头滴管。
(3)①导致容量瓶中的溶液体积偏小,结果偏高。②不影响。③导致溶质的物质的量减少,结果偏低。④导致溶质的物质的量减少,结果偏低。
(4)定容时液面一旦高于刻度线,则结果偏低,即实验已经失败,需要重新配制。
本题难度:一般
5、实验题 用18 mol/L浓硫酸配制100ml 3.0mol/L稀硫酸实验步骤如下:①计算所用硫酸的体积?②量取一定体积的浓硫酸?③溶解?④转移、洗涤?⑤定容、摇匀
回答下列问题:
(1)(2分)所需浓硫酸的体积是_________ml;
(2)(5分)所需要的仪器有:容量瓶(规格:__________)、量筒(规格:__________)
(从下列中选用填序号:A、10ml? B、25ml? C、500ml? D、250ml? E、100ml),
除此之外还需要的仪器有:____________________________________________________。
(3)(10分)下列情况对所配制的稀硫酸浓度有何影响?(用偏高、偏低、无影响填写)
A、所用的溶解仪器未洗涤_________________;
B、容量瓶用蒸馏水洗涤后未干燥_________________;
C、所用的浓硫酸长时间放置在敞口容器内_________________;
D、定容时仰视溶液的凹液面_________________;
E、溶解后立即转移到容量瓶中定容_________________。
参考答案:
(1)16.7;
(2)E,B,烧杯、胶头滴管、玻璃棒
(3)偏低,无影响,偏低,偏低,偏高
本题解析:略
本题难度:简单