微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 “阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答下列有关问题。
步骤(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已部分被_______________________;
步骤(2)将步骤(1)中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是____________________;
步骤(3)取步骤(2)中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通人足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。8.0 g滤渣中活性炭的质量为_____________;
步骤(4)将步骤(3)中的另一份滤渣放入烧杯中,加入一定体积2.0 mol/L的稀H2SO4,微热至反应完全,滤出不溶物。
步骤(5)向步骤(4)中的滤液中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比约为___________。
参考答案:氧化;除去氯化钠;2.49;2:1
本题解析:
本题难度:一般
2、实验题 (12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。

1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择?(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
?。
2.Ⅲ中水冷凝管的进水口是?(选答“a”或“b”)。冰盐水的作用是?。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设
计了以下几种装置与导管d连接,你认为合理的是(选填编号)?。

4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中有气体生成化学方程式(写两个方程式)?;?。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
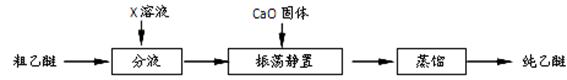
(1)分液步骤除去产品中的酸性杂质,则X可以是?。
(2)蒸馏操作可除去的杂质是?。
参考答案:(12分)
1.(1)I?(2)防止乙醇挥发(各1分)
2.b?冷凝液化乙醚(各1分)
3.c、d(2分)
4. CH3CH2OH+4H2SO4(浓) △ C+CO2↑+4SO2↑+7H2O

5.(1)NaOH溶液 (1分)?(2)乙醇?(1分)
本题解析:1、(1)控制反应温度为140℃,温度计应放在反应液中,故选Ⅰ;(2)把乙醇直接加入溶液中,乙醇溶于有机溶剂,减少乙醇的挥发;2、冷凝管的水从下口进,上口出,逆流冷凝效果好;根据乙醇和乙醚的沸点,用冰盐水可将乙醚冷凝;3、用溴水吸收乙烯,还要防倒吸,排除a、b,a中不能将溴乙烷和乙醚分离开来,b不能防倒吸,故选c,d;4、乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,浓硫酸会将乙醇氧化为二氧化碳或是碳单质等;5、(1)和酸性物质可以反应的是碱液,故选氢氧化钠溶液;(2)蒸馏可以将沸点不同的物质进行分离,故可将乙醇分离出来。
本题难度:一般
3、实验题 (8分)为了测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验:
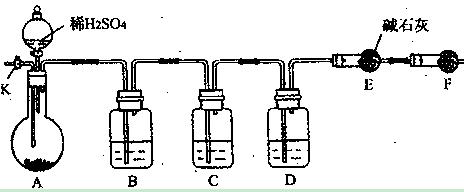
(1)将仪器连接好以后,必须进行的第一步操作是?;
(2)装置B的作用是? ;
;
(3)已知装置C中装有品红溶液, 其作用是?;
其作用是?;
(4)实验室中备有以下常用试剂:a.浓硫酸? b. 品红溶液? c. 酸性高锰酸钾溶液
d. 饱和碳酸氢钠溶液? e. 氢氧化钠溶液? f. 无水硫酸铜? g. 碱石灰
请将下列装置中应盛放的试剂的序号填在横线上:
B中应盛放?,D中应盛放?,F中应盛放?;
(5)若装置E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为?。
参考答案:(第五小问2分,其余每空1分,共8分)
(1)检验装置的气密性
(2)除去二氧化碳中的二氧化硫气体
(3)检验二氧化硫是否已除尽
(4)B中:e? D中:a? F中g
(5)1:1
本题解析:略
本题难度:简单
4、实验题 牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质。牙膏中的摩擦剂一般由CaCO3、Al(OH)3、SiO2中的一种或儿种物质组成。为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤。在滤渣中加入足量盐酸后,发现仍有少铽不溶物。为进一步探究牙膏中摩擦剂成分,同学们进行了以下探究:
(1)【提出假设】根据题目信息同学们提出了如下假设:
假设1:牙膏摩擦剂的成分为SiO2和CaCO3?
假设2:牙膏摩擦剂的成分为SiO2和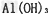 ?
?
假设?3:?________________
[实验验证] 设计实验方茱,验证假设。请写出实验步骤以及预期现象和结论.(可不填满也可补充)。可选的试剂:稀盐酸、稀硫酸、NaOH溶液、澄淸石灰水

(2)【交流提髙】办组同学了解到一些品牌牙膏中的摩擦剂使用了纳米级碳酸钙。查阅资料知工业上常将电石渣进行处理,得到Ca(OH)2悬浊液,畀不断通入CO2,即可制得纳米级的CaCO3。通过传感器测得反应过程中溶液pH与反应时间的关系如下图。

试回答:
①反应一段时间内,PH变化很小的原因是__________________;
②临近反应终点时,溶液的PH急剧下降的原因是__________________。
参考答案:(1)假设3:牙膏摩擦剂的成分为SiO2、CaCO3和Al(OH)3?
【实验验证】 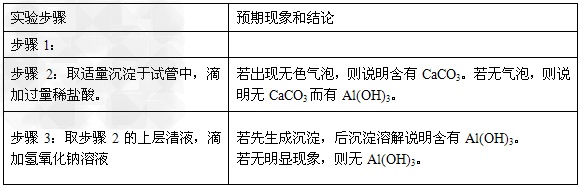 (2)①随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,故pH变化很小
(2)①随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,故pH变化很小
②临近反应终点时,Ca(OH)2大部分转化为CaCO3,溶液中OH-浓度下降而CO2仍在不断通入,故pH急剧下降
本题解析:
本题难度:一般
5、实验题 维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应。人体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
猜想:维生素C可能具有酸性。
(1)实验方案:提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸。根据以上试剂,请你帮助他们设计出实验方案,并写出实验现象:

(2)结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是_________
A.金属镁 B.食盐 C.氢氧化钠 D.硫酸铜
(3)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响?他设计了如下
实验方案:
I.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ,取两支盛有2mL蓝色碘的淀粉溶液的试管,分别往其中滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录所用两种汁液的滴数如下

你认为西红柿中维生素C含量高的是__________________
参考答案:(1)石蕊溶液由紫色变红色
(2)AC
(3)新鲜西红柿
本题解析:
本题难度:一般