微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 几种短周期元素的原子半径及主要化合价见下表:
元素符号
| X
| Y
| Z
| R
| T
|
原子半径(nm)
| 0.160
| 0.080
| 0.102
| 0.143
| 0.074
|
主要化合价
| +2
| +2
| -2,+4,+6
| +3
| -2
|
根据表中信息,判断以下说法正确的是?(?)
A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:T2->X2+
C.元素最高价氧化物的水化物的碱性:Y > R >X
D.单质与氢气化合的难易程度:Z>T
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (12分)在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1) 锂在空气中燃烧主要产物的电子式是??,同时生成少量的?。
(2)铍的最高价氧化物对应的水化物的化学式是?,它属 化合物(选填“酸性”、“碱性”、“两性”),写出证明此结论的离子方程式
?
(3)用电子式表示BeCl2的形成过程:?。
(4)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3固体与过量的NaOH溶液反应的离子方程式为?。
(5)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
?。
参考答案:(1)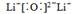 ?Li3N
?Li3N
(2)Be(OH)2?两性
Be(OH)2+2H+===Be2++2H2O
Be(OH)2+2OH-===BeO22—+2H2O
(3)Al4C3+4OH-+4H2O ===4AlO2—+3CH4↑
===4AlO2—+3CH4↑
(4)将BeCl2加热到熔融状态不能导电证明BeCl2是共价化合物
(5)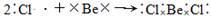
本题解析:略
本题难度:一般
3、填空题 决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1
| I1
| I2
| I3
| I4
|
A
| 578
| 1817
| 2745
| 11578
|
B
| 738
| 1451
| 7733
| 10540
|
A通常显 ?价,A的电负性? ?B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长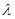 与光的频率v的关系为
与光的频率v的关系为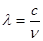 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:?
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:?
? ?。(未说明原因不给分)
共价键
| C—C
| C—N
| C—S
|
键能/kJ·mol-1
| 347
| 305
| 259
|
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
离子晶体
| NaCl
| KCl
| CaO
|
晶格能/kJ·mol-1
| 786
| 715
| 3401
|
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是? ?。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有? ?个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是? ?。
(5) [Cu(NH3)4]SO4中存在的化学键类型有?(填序号)。
A.共价键? B.氢键? C.离子键? D.配位键? E.分子间作用力?
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
参考答案:(1)+3(1分) >(1分)(2)399(1分) 紫外光具有的能量足以使蛋白质分子中的化学键断裂,从而破坏蛋白质分子(1分)(3)TiN>CaO>KCl(1分) 12(1分)(4)CrO2(1分)(5)ACD?(不全给1分,全对给2分,有错不给) 三角锥形(1分) 极性(1分)
本题解析:(1)A和B为第三周期元素,根据其电离能数据可知,A为Al,B为Mg,故A通常显+3价,A的电负性>B的电负性。(2)1mol光子的能量为E=hvNA=6.63×10-34J·s×3×108m·s-1÷300×10-9m×6.02×1023mol-1=3.99×105J·mol-1="399k" J·mol-1;由此可看出紫外光具有的能量足以使蛋白质分子中的化学键断裂,从而破坏蛋白质分子,使皮肤受伤害。(3)晶格能越大,熔沸点越高,根据晶格能数据可知,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序为TiN>CaO>KCl;MgO晶体与NaCl的晶体结构相似,故一个Mg2+周围和它最邻近且等距离的Mg2+为12个。(4)因为Cr含未成对电子越多,故适合作录音带磁粉原料的为CrO2。(5) [Cu(NH3)4]SO4中存在的化学键类型有离子键、共价键、配位键;NH3分子的空间构型为三角锥型,属于极性分子。
本题难度:一般
4、选择题 金刚石、石墨的关系是
A.同系物
B.同位素
C.同分异构体
D.同素异形体
参考答案:D
本题解析:同素异形体的定义:同种元素形成的性质不同的单质,故选D;
本题难度:简单
5、填空题 (5分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
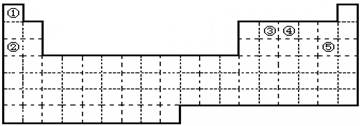
(1)上述五种元素中,金属性最强的元素在周期表中的位置是?,
该元素的单质在空气中加热的化学方程式为?。
(2)元素①和④形成化合物的电子式是?,其水溶液呈?(填“碱性”、“酸性”或“中性”)。
(3)试用电子式表示元素⑤单质分子的形成过程?。
参考答案:(1)第三周期第IA?2Na+O2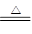 Na2O2
Na2O2
(2)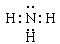 碱性?(3)
碱性?(3)
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断,①~⑤分别是H、Na、C、N、Cl。
(1)金属性最强的是Na,位于第三周期第IA。钠在空气中燃烧生成过氧化钠,方程式为2Na+O2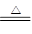 Na2O2。
Na2O2。
(2)H和N都是非金属,通过共价键形成氨气,氨气溶于水生成一水合氨,显碱性。
(3)氯气是通过非极性键形成的单质分子,其形成过程为。
本题难度:一般