微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠
(Na2Cr2O7·2H2O),其主要反应:( )
①4FeO·Cr2O3+8Na2CO3+7O2 ?8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4
?8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法不正确的是( )
A.反应①和②均为氧化还原反应
B.Na2Cr2O7在碱性条件下可转化为Na2CrO4
C.高温下,O2的氧化性大于Fe2O3和Na2CrO4的
D.生成1 mol Na2Cr2O7时转移电子的物质的量大于7 mol
参考答案:A
本题解析:反应①为氧化还原反应,反应②不是,A错误;根据氧化剂的氧化性大于氧化产物的氧化性,知O2的氧化性应大于Fe2O3和Na2CrO4的,C正确;考虑到反应②是一个可逆反应,反应中生成1 mol Na2Cr2O7时,转移电子的物质的量应大于7 mol,D正确;同时可以看出,加碱可以使平衡左移,B正确。
本题难度:一般
2、选择题 已知2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2,H2S + I2 =" 2HI" + S,下列叙述正确的是(?)
A.氧化性:Fe3+>I2>S
B.氧化性:I2>S>Fe3+
C.还原性:Fe2+>I->H2S
D.还原性:Fe2+>H2S>I-
参考答案:A
本题解析:根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物可推得。氧化性:Fe3+>I2>S;而还原性:Fe2+<I-<H2S
本题难度:一般
3、选择题 已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:H2O2<Fe2+<I-<SO2。则下列反应不能发生的是
[? ]
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.H2O2+H2SO4=SO2↑+O2↑+2H2O
C.I2+SO2+2H2O=H2SO4+2HI
D.2Fe3++2I-=2Fe2++I2
参考答案:B
本题解析:
本题难度:一般
4、填空题 (1)某学生用KMnO4制备氯气,反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
当有15.8g KMnO4参加反应时,消耗 molHCl,其中被氧化的HCl有 mol,有 mol电子转移,标准状况下生成Cl 2的体积为 L。
(2)生成的氯气缓慢通入KI-淀粉溶液中,出现蓝色,离子方程式为 ,若氯气用量(物质的量)达到KI的3倍时,蓝色完全消失,已知此时生成物中含碘物质只有一种,那么该物质中碘的化合价为 。
参考答案:(1)0.8 0.5 0.5 5.6 (2)Cl2 + 2I-= I2 + 2Cl- +5
本题解析:(1)15.8g高锰酸钾的物质的量是15.8g÷158g/mol=0.1mol,则根据反应的化学方程式可知,参加反应的氯化氢是0.1mol×8=0.8mol。其中被氧化的氯化氢是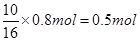 。氯元素的化合价从-1价升高到0价,失去1个电子,则转移电子的物质的量是0.5mol×1=0.5mol。根据方程式可知,生成氯气的体积在标准状况下是0.25mol×22.4L/mol=5.6L。
。氯元素的化合价从-1价升高到0价,失去1个电子,则转移电子的物质的量是0.5mol×1=0.5mol。根据方程式可知,生成氯气的体积在标准状况下是0.25mol×22.4L/mol=5.6L。
(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,反应的离子方程式是Cl2 + 2I-= I2 + 2Cl-。设参加反应的碘化钾是1mol,则氯气是3mol,所以根据电子的得失守恒可知,1mol碘化钾失去3mol×2=6mol,则反应后碘元素的化合价是+5价。
考点:考查氧化还原反应的有关计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生的逻辑推理能力和灵活应变能力。该题的关键是准确判断出有关元素的化合价变化情况,然后根据电子的得失守恒即可得出正确的结论。
本题难度:一般
5、填空题 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘、镁等。按要求回答下列问题:
(1)可以证明溴比碘的氧化性强的离子反应方程式为____________________________。
(2)从海带灰中提取的碘单质,往往含有一定的杂质,通常利用加热的方法除去杂质,这个过程中主要利用碘性质中的___________,也可以通过萃取分液的方法提取碘,实验室中分液时,分液漏斗中的上层液体应从分液漏斗的_______(填“上”或“下”)口倒出。
(3)点燃的镁条可以在二氧化碳气体中继续燃烧,该反应的化学方程式为__________。
参考答案:(1)2I-+Br2=I2+2Br- (2)单质碘易升华; 上 (3)2Mg+CO2 2MgO+C
2MgO+C
本题解析:(1)单质溴能把碘离子氧化生成单质碘,根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性可知,溴比碘氧化性强,反应的离子方程式为2I-+Br2=I2+2Br-。
(2)由于碘单质易升华,所以通常利用加热的方法除去单质碘中的杂质。分液时分液漏斗中的上层液体应从分液漏斗的上口倒出,下层液体从小口流出。
(3)镁可以在CO2中燃烧生成氧化镁和碳,反应的化学方程式为2Mg+CO2 2MgO+C。2中燃烧
2MgO+C。2中燃烧
本题难度:一般