微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列粒子属等电子体的是
A.NO和O2
B.CH4和NH4+
C.NH2?和H2O2
D.HCl和H2O
参考答案:B
本题解析:试题分析:原子数和电子数分别都相等的是等电子体,A中电子数不同,C、D中原子数和电子数分别都不同,答案选B。
考点:考查等电子体的判断
点评:该题是基础性试题的考查,试题注重基础,兼顾能力的培养。该题的关键是明确等电子体的含义,难度不大,学生不难得分。
本题难度:简单
2、选择题 下列物质既含有离子键,又含有共价键的是
A.H2
B.NaOH
C.MgCl2
D.HCl
参考答案:B
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,加成可知,A~D中含有的化学键分别是非极性键、离子键和极性键、离子键、极性键。所以答案选B。
本题难度:一般
3、选择题 将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4,NO2)的混合物共0.8mol,这些气体恰好能被500mL?2mol/L?NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO+NO2+2NaOH=2NaNO2+H2O则生成的盐溶液中NaNO3的物质的量为
A.0.4mol
B.0.2mol
C.0.6mol
D.0.8mol
参考答案:B
本题解析:分析:51.2gCu的物质的量为0.8mol,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,我们可以认为铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),根据钠元素守恒n(NaNO2)+n(NaNO3)=1mol.据此解答.
解答:51.2gCu的物质的量为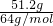 =0.8mol,
=0.8mol,
铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,
则铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,
根据得失电子数目相等得到2n(Cu)=2n(NaNO2),
所以n(NaNO2)=n(Cu)=0.8mol,
根据钠元素守恒可知n(NaNO2)+n(NaNO3)=0.5L×2mol/L=1mol.
所以n(NaNO3)=1mol-0.8mol=0.2mol.
故选B.
点评:本题考查氧化还原反应的计算,难度较大,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,清楚铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2是解题的关键.
本题难度:一般
4、选择题 已知t℃时,某物质的不饱和溶液a克中含溶质m克,若该溶液蒸发b克水并恢复到t℃时,析出溶质m1克.若原溶液蒸发c克水并恢复到t℃时,则析出溶质m2克.用S表示该物质在t℃时的溶解度,下式中正确的是
A.S=
B.S=
C.S=
D.S=
参考答案:C
本题解析:分析:已知不饱和溶液蒸发水,析出溶质时恢复到原温度,则溶液变为饱和溶液,然后利用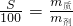 来计算.
来计算.
解答:现为不饱和溶液,两次蒸发都有溶质析出即都变为饱和,设第一次蒸发的水多,则析出溶质也一定多;
然后把第一次蒸发分作两步,即先完成第二步,这时蒸发了cg水,析出m2g溶液中质,溶液一定为饱和,在此基础上多蒸发了(b-c)g水多析出溶质为(m1-m2)g,
即该温度下,(b-c)g水最多溶解溶质为(m1-m2)g,
由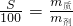 可知,
可知,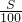 =
=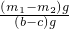 ,
,
解得S=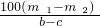 ,
,
故选C.
点评:本题考查溶解度,饱和溶液的概念,理解饱和溶液中质量分数不变是解题的关键.
本题难度:一般
5、选择题 与1mol NH3所含有的分子数目相同的是
A.0.5mol O2
B.1mol Fe
C.2mol H2
D.2mol H2O
参考答案:B
本题解析:只从简单的物质的量上来看,答案为B
注:铁是金属晶体,不是由分子直接组成,故本题没有准确的选项
本题难度:困难