微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,书写不正确的是?(?)?
A.氯化钠溶液中加入硝酸银溶液:Ag+ + Cl- = AgCl↓
B.把金属钠放入水中:Na + 2H2O =" Na+" +2OH- + H2
C.将氯水加入碘化钾溶液中:Cl2 + 2I- ="" 2Cl- + I2
D.盐酸滴在石灰石上:CaCO3 + 2H+ =" Ca2+" + CO2↑ + H2O
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列反应的离子方程式正确的是(?)?
A.铁与稀硫酸反应2Fe+6H+→2Fe3++3H2↑
B.铝盐溶液与氨水反应Al3++3OH-→Al(OH)3↓
C.碳酸钙与稀盐酸反应CO32-+2H+→CO2↑+H2O
D.铁与氯化铁溶液反应Fe+2Fe3+→3Fe2+
参考答案:D
本题解析:A、不符合反应事实,应该生成二价铁;
B、氨水为弱电解,不能拆开;
C、碳酸钙不溶于水,不能拆开。
本题难度:一般
3、选择题 下列化学反应的离子方程式正确的是
A.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
B.稀氨水中通入少量CO2:2NH3·H2O+CO2=2NH4++CO32- +H2O
C.碳酸钡与硫酸反应:Ba2++SO42-===BaSO4↓
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O
参考答案:B
本题解析:A错,醋酸为弱酸不能拆成离子形式;B正确;C错,碳酸钡为难溶于水的物质不能拆成离子;D错,正确离子方程式为:Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O;
本题难度:一般
4、选择题 下列化学反应的离子方程式正确的是( )
A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
参考答案:A、碳酸钡中滴加稀盐酸时,碳酸钡是难溶于水的盐,不能拆成离子,故A错误;
B、小苏打是碳酸氢钠的俗称,胃酸的主要成分是盐酸,碳酸氢根离子和氢离子之间反应生成水和二氧化碳,即HCO3-+H+=CO2↑+H2O,故B正确;
C、氨水是弱酸,不能拆成离子,并且氢氧化铝不能溶于氨水中,故C错误;
D、氢氧化钡电离出的钡离子和氢氧根离子量之比是1:2,硫酸中电离出的氢离子和硫酸根离子之间的量之比是2:1,所以氢氧化钡溶液与稀硫酸反应的实质是:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故D错误.
故选B.
本题解析:
本题难度:一般
5、简答题 已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
(1)A的元素符号为______,C的氢化物的化学式为______.
(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为______.
(3)1molC的氢化物与足量C的氧化物反应,转移的电子的物质的量为______mol.
(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如图,请写出E与F反应生成G的离子方程式______.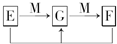
参考答案:(1)A原子的最外层与次外层电子数相等可知A为Be.A与D最外层电子数之和为9,可知D最外层7个电子,且分别属于不同的主族,D为Cl.和为9,且A、B、C、D中只有两种金属元素,可知B最外层3个电子,B为Al.C为S.C的氢化物的化学式为H2S.
(2)氧化性:Cl2>S,根据氧化性:氧化剂>氧化产物,则有H2S+Cl2═S↓+2HCl.
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱.如:Fe+S?△?.?FeS,2Fe+3Cl2?△?.?2FeCl3
(3)SO2+2H2S=3S↓+2H2O,1mol二氧化硫得到4mol电子,1mol硫化氢失2mol电子.
(4)B为Al,常见存在形式为AlO2-,Al(OH)3,Al3+,
故答案为:(1)Be H2S
(2)Fe+S?△?.?FeS,2Fe+3Cl2?△?.?2FeCl3(或H2S+Cl2═S↓+2HCl)
(3)2
(4)Al3++3AlO2-+6H2O═4Al(OH)3
本题解析:
本题难度:一般