微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,不可能出现的结果是
A.烧杯中有铜无铁
B.烧杯中有铁无铜
C.烧杯中铁、铜都有
D.烧杯中铁、铜都无
参考答案:B
本题解析:铁粉和铜粉都有欢迎性能。但还原性铁>铜。所以向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,还原性强的铁粉先发生反应产生氯化亚铁,当铁粉反应完全后铜粉再发生反应产生氯化亚铁和氯化铜。故反应结束后烧杯中补可能出现有铁无铜的情况。选项为 :B.
本题难度:一般
2、选择题 下列关于铁元素的叙述中正确的是( )
A.2Fe3++Cu===2Fe2++Cu2+成立说明氧化性:Fe3+> Cu 2+
B.25℃,pH=0的溶液中,Al3+、NH4+、NO3—、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变红色
参考答案:A
本题解析:A、反应中Fe3+做氧化剂 Cu 2+是氧化产物。根据氧化还原反应的氧化性判断规律,氧化性:氧化剂>氧化产物,所以A正确。故选A。
B、pH=0的溶液中,溶液含有较大浓度的H+,NO具有强氧化性与还原性的Fe2+不能大量共存。
C、5.6gFe为0.1mol与氯气反应时被氧化成Fe3+失去电子为0.3mol。故C错误。
D、硫酸铁溶液中加入铁粉,Fe3+不一定反应完全,滴加KSCN溶液有可能变红色。D错误。
点评:掌握铁及其化合物的相关性质是解题的关键。
本题难度:一般
3、选择题 在酸性溶液中,下列各组离子能大量共存的是(? )
A.Fe3+、NO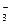 、Cl-、Al3+
、Cl-、Al3+
B.Fe3+、Cl-、I-、K+
C.Fe2+、K+、SO 、NO
、NO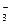
D.Fe2+、SO 、K+、MnO
、K+、MnO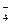
参考答案:A
本题解析:A选项符合题意;B选项中Fe3+和I-能发生氧化还原反应;C、D选项中Fe2+在酸性条件下能被NO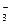 、MnO
、MnO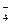 氧化。
氧化。
本题难度:简单
4、填空题 氯化铁是常见的水处理剂,无水FeCl3易升华。工业上制备无水FeCl3的一种工艺如图所示:
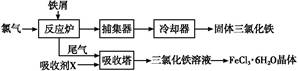
(1)加入吸收塔的吸收剂X应是?(填字母编号)。
a.NaOH溶液? b.饱和食盐水? c.FeCl2溶液? d.淀粉KI溶液
(2)取0.5 mL饱和FeCl3溶液滴入50 mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为?。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入?且保持过量,然后进行的操作依次为?、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为?。
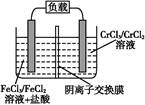
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+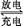 Fe2++Cr3+
Fe2++Cr3+
则电池放电时,Cl-将移向?极(填“正”或“负”);充电时,阴极的电极反应式为?。
参考答案:(1)c
(2)Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
(3)盐酸 蒸发浓缩(或加热蒸发)
(4)H2S+2Fe3+ 2Fe2++S↓+2H+
2Fe2++S↓+2H+
(5)负 Cr3++e- Cr2+
Cr2+
本题解析:(1)根据流程图可知,从反应炉中排出的尾气是剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液。(3)从FeCl3溶液制得FeCl3·6H2O晶体的过程中,为抑制Fe3+的水解,需先加入盐酸且保持过量,然后依次进行蒸发浓缩、冷却结晶、过滤等操作。(4)H2S气体通入FeCl3溶液中,Fe3+将H2S氧化为S,Fe3+被还原为Fe2+。(5)电池工作时,电解质溶液中的阴离子移向负极,则铁铬氧化还原液流电池放电时,Cl-将移向负极;充电时,阴极发生还原反应,Cr3+得电子生成Cr2+,即Cr3++e- Cr2+。
Cr2+。
本题难度:一般
5、选择题 为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中? (? )
A.通入氯气
B.加入Zn
C.加入Fe
D.加入Cu
参考答案:C
本题解析:除杂的基本原则是不增不减,易分离易复原。故最好加入Fe,反应后过滤,得到只有Fe2+。
本题难度:一般