微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某实验需要用到80mL 1.5 mol/L稀H2SO4溶液,现用18.4mol/L的浓硫酸(ρ=1.84g·cm-3)进行配制。
(1)所需浓硫酸最小体积为_________。
(2)量取所需浓H2SO4,应选用__________mL量筒。(填5、10或50)
(3)稀释浓H2SO4的方法(简要操作)_________________________________。
(4)容量瓶使用前,检验其是否漏水的方法是_______________________________。
(5)稀释后的浓H2SO4若立即转移至容量瓶中,所配溶液的浓度将____________。(填偏大、偏小或不变)
(6)定容时俯视刻线,所配溶液的浓度将__________________。(填偏大、偏小或不变)
参考答案:(1)8.2mL
(2)10
(3)向盛有一定量水的烧杯中沿烧杯内壁慢慢倒入浓H2SO4,并不断搅拌
(4)向容量瓶中加入少量的水盖上塞子倒置,观察是否漏液,然后旋转塞子180°,重复检验
(5)偏大
(6)偏大
本题解析:
本题难度:一般
2、选择题 下列各项所述的两个量,前者一定大于后者的是

 ①纯水在25℃和80℃的pH
①纯水在25℃和80℃的pH
 ②1mol NaHSO4和1molNa2SO4在熔化状态下的离子数
②1mol NaHSO4和1molNa2SO4在熔化状态下的离子数
 ③25℃时,等体积且pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数
③25℃时,等体积且pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数
 ④Na+和F-的离子半径
④Na+和F-的离子半径

A.②④
B.只有①
C.①③
D.只有②
参考答案:B
本题解析:略
本题难度:一般
3、计算题 已知某盐酸密度为1.19 g·mL-1,HCl的物质的量浓度为12 mol·L-1,求该盐酸中HCl的质量分数。
参考答案:36.8%
本题解析:由溶液的密度、溶质质量分数和溶质物质的量浓度三者之间的关系及本题的已知条件,可用以下公式解得:
c(B)=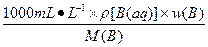
c(HCl)=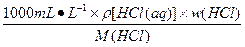
w(HCl)=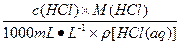 ×100%
×100%
=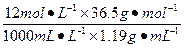 ×100%
×100%
=36.8%
答:盐酸中HCl的质量分数为36.8%。
本题难度:简单
4、选择题 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与Al2(SO4)3的物质的量浓度之比为
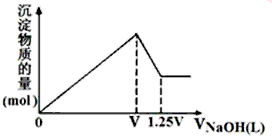
[? ]
A.1:1
B.2:3
C.3:2
D.2:1
参考答案:A
本题解析:
本题难度:一般
5、选择题 某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示:下列说法不正确的是
盐酸/mL
| 50
| 50
| 50
|
固体混合物质量/g
| 9.2
| 15.7
| 27.6
|
标准状况下CO2体积/L
| 2.24
| 3.36
| 3.36
|
?
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入9.2 g固体混合物时盐酸过量
D.15.7 g固体混合物恰好与盐酸完全反应
参考答案:D
本题解析:A项,由表中数据可知,计算盐酸浓度时需选择盐酸不足量的数据,如随着固体混合物质量增加,产生标准状况下二氧化碳气体的体积不再增加,表明盐酸已反应完全,H++HCO===H2O+CO2↑,c(HCl)=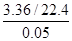 =3.0 mol/L,正确;B项,根据表中第一组数据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数,正确;C项,由于固体混合物的质量从9.2 g增加到15.7 g,产生标准状况下二氧化碳气体的体积也在增加,故加入9.2 g固体混合物时盐酸过量,正确;D项,根据固体混合物与气体的比例关系可知,产生标准状况下3.36 L二氧化碳所需固体质量为
=3.0 mol/L,正确;B项,根据表中第一组数据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数,正确;C项,由于固体混合物的质量从9.2 g增加到15.7 g,产生标准状况下二氧化碳气体的体积也在增加,故加入9.2 g固体混合物时盐酸过量,正确;D项,根据固体混合物与气体的比例关系可知,产生标准状况下3.36 L二氧化碳所需固体质量为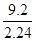 =
=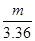 ,解得m=13.8 g,此时盐酸恰好完全反应,故不正确。
,解得m=13.8 g,此时盐酸恰好完全反应,故不正确。
本题难度:一般